| autor | Afiliere |
|---|---|
| Lindsay A. Weiner, MD | Centrul Medical al Universității din Maryland, Baltimore, Maryland |
| George Willis, MD | Universitatea din Maryland Scoala de Medicina, Departamentul de Medicina de Urgenta, Baltimore, Maryland |
| Zachary D. W. Dezman, MD, MS, MS | Universitatea din Maryland Scoala de Medicina, Departamentul de Medicina de Urgenta, Baltimore, Maryland |
| Laura J. Bontempo, MD, MEd | Universitatea din Maryland Scoala de Medicina, Departamentul de Medicina de Urgenta, Baltimore, Maryland |
prezentare de caz
discuție de caz
rezultatul cazului
discuție rezidentă
diagnostic Final
puncte cheie de predare
prezentare de caz
o femeie de 52 de ani a venit la Departamentul de urgență (ED) pentru hemodializă (HD) din cauza bolii renale în stadiu final (ESRD). Ea a petrecut ultimele câteva săptămâni într-un spital extern, fiind tratată pentru pneumonie și bacteremie cu daptomicină. Ulterior a plecat împotriva sfaturilor medicale (AMA) după ce i s-a îndepărtat cateterul de acces la dializă. Ea s-a prezentat ED-ului nostru pentru că avea nevoie de plasarea accesului vascular HD și re-inițierea tratamentelor de dializă. Istoricul ei medical a inclus boli renale cronice secundare nefrosclerozei hipertensive, anemie, hipertensiune arterială, tromboze venoase profunde (TVP), lupus eritematos sistemic și o tulburare convulsivă de etiologie necunoscută.
pacientul, martor al lui Iehova, a refuzat transfuziile de sânge; prin urmare, anemia ei a fost tratată cu administrare intravenoasă (IV) de fier, epoetină alfa și folat. Alte medicamente au inclus nifedipină, clonidină, metoprolol, sevelamer și prednison. Era alergică la amoxicilină, azitromicină, hidralazină, labetolol, linezolid, morfină și vancomicină. Ea a raportat consumul anterior de heroină IV cu mulți ani mai devreme și fumatul anterior. Ea a negat consumul de alcool sau orice consum actual de droguri sau tutun.
la sosire, ea a fost de alertă și în nici o primejdie acută cu o febră de 38.3 centimetric, puls de 87 bătăi pe minut( bpm), tensiune arterială de 110/65 milimetri mercur (mmHg), frecvență respiratorie de 17 respirații pe minut și puls oximetrie de 99% în timp ce respiră aerul din cameră. Cântărea 80 de kilograme și avea o înălțime de 5 picioare și 6 inci. Capul ei era normocefalic și atraumatic cu mucoase umede. Elevii erau anicterici, egali, rotunzi și reactivi la lumină și acomodare. Gâtul era suplu și fără limfadenopatie sau sensibilitate. Plămânii ei aveau sunete de respirație grosiere, cu crackle bibasilare ușoare, dar fără șuierături sau rhonchi. Nu au existat retrageri sau lucrări sporite de respirație. Inima ei a fost de ritm regulat și ritm fără murmure, freacă, sau galopuri. Abdomenul ei era moale, cu sunete intestinale normale și fără distensie, sensibilitate, revenire sau pază. Nu a existat o sensibilitate a unghiului costovertebral. Extremitățile inferioare au avut 1 + edem pitting, 2 + impulsuri dorsalis pedis și au fost fără sensibilitate sau deformare. Pacientul a avut o forță normală și un tonus muscular în toate extremitățile cu senzație intactă. Fistulele vechi erau prezente în extremitățile superioare stângi și drepte, fără emoții palpabile. Era alertă și orientată spre persoană, loc și timp.
valorile inițiale de laborator ale pacientului sunt prezentate în tabelul 1. Acestea au fost semnificative pentru o ușoară leucocitoză, anemie la 5,3 g/dL, trombocitopenie, hiperkaliemie și o creatinină crescută de 11,9 mg/dl. Electrocardiograma inițială (ECG) a arătat o tahicardie sinusală cu inversiuni ale undelor T în conductele I și V6 (Imaginea 1). Acest lucru a fost neschimbat de la un ECG anterior. Pacientul a fost internat în echipa medicală și a început tratamentul cu daptomicină. În așteptarea plasării patului, un cateter de dializă femurală stângă fără tunel a fost introdus de către unitatea de terapie intensivă medicală (UCI) pentru inițierea HD. Plasarea a fost confirmată de dezavantajul ușor al sângelui din toate porturile. În timpul procesului de consimțământ pentru plasarea cateterului, s-a documentat că pacientul a declarat că „ar prefera să moară decât să primească transfuzii de sânge.”După plasarea cateterului, s-a încercat pornirea HD, dar a devenit hipotensivă și s-a plâns de slăbiciune aproape imediat. Semnele sale vitale în timpul încercării inițiale HD au fost o tensiune arterială de 85/56 mmHg cu o frecvență cardiacă de 105 bpm.
| valori | |
|---|---|
| număr complet de celule sanguine | |
| număr de celule albe din sânge | 12,4 K / mcl |
| hemoglobina | 5,3 g / dL |
| Hematocrit | 15.8% |
| Platelets | 133 K/mcl |
| Basic metabolic panel | |
| Sodium | 135 mmol/L |
| Potassium | 5.8 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 27 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 189 mg/dL |
| Calcium | 7.2 mg / dL |
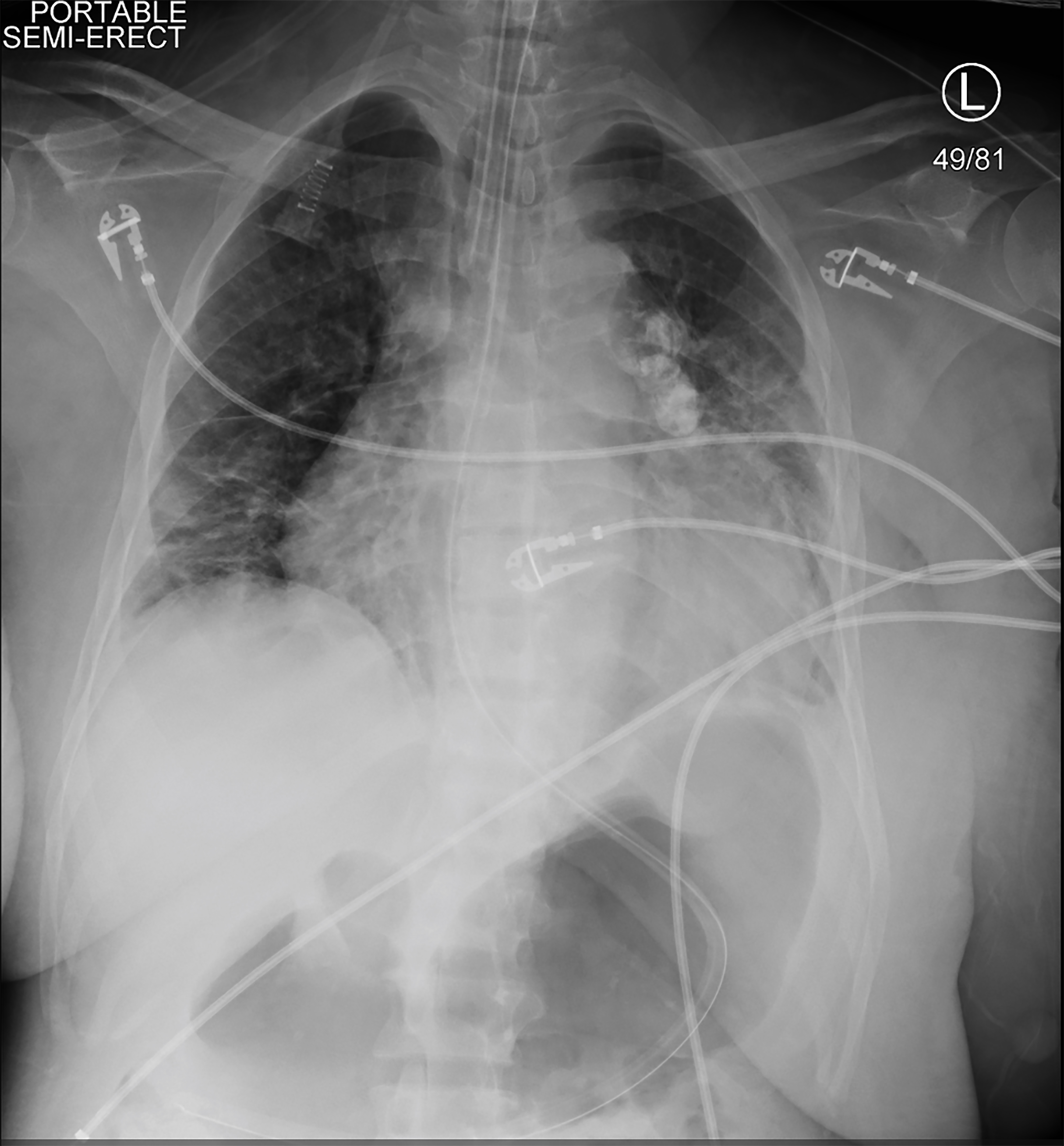
deoarece pacientul a fost simptomatic și hipotensiv în timpul HD, a fost inițiată terapia de substituție renală continuă (CRRT). La scurt timp după aceea, a devenit hipotensivă, nu a răspuns și a avut o criză tonică clonică. Semnele vitale la acel moment erau o frecvență cardiacă de 113 bpm, tensiunea arterială 75/48 mmHg, rata respiratorie de 20 respirații pe minut și saturația oxigenului de 78% în aerul din cameră. Un examen fizic scurt, repetat, a arătat că pacienta nu răspundea la stimuli dureroși, iar elevii ei erau egali și reactivi. I s-a administrat 4 mg de lorazepam și intubat pentru protecția căilor respiratorii. Au fost plasate o linie femurală arterială dreaptă și o linie centrală venoasă triplă femurală dreaptă. O radiografie toracică a confirmat plasarea tubului endotraheal (Imaginea 2). CRRT a fost oprit, dar pacientul a rămas în stare de șoc, în ciuda perfuziilor în bolus de cristaloid, așa că au început vasopresoarele. Ea a primit doze crescânde de vasopresoare când valorile repetate de laborator au indicat o hemoglobină de 1,6 g/dL (Tabelul 2).
| Values (prior value) | |
|---|---|
| Complete blood cell count | |
| White blood cell count | 13.4 K/mcl (12.4 K/mcl) |
| Hemoglobin | 1.6 g/dL (5.3 g/dL) |
| Hematocrit | 5.7% (15.8%) |
| Platelets | 167 K/mcl (133K/mcl) |
| Complete metabolic panel | |
| Sodium | 131 mmol/L |
| Potassium | 6.7 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 14 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 169 mg/dL |
| Alanine aminotransferase | 23 u/L |
| Aspartate aminotransferase | 31 u/L |
| Alkaline phosphatase | 145 u/L |
| Total bilirubin | 0.4 mg / dL |
| proteină totală | 5,8 g / dL |
| albumină | 3, 2 g/dL |
| lactat | 15 u / L |
| gaz Arterial din sânge | |
| pH | 7.23 |
| PCO2 | 28 mmHg |
| PO2 | 214 mmHg |
la scurt timp după aceea a intrat în stop cardiac cu un ritm de activitate electrică fără impulsuri (PEA). Revenirea circulației spontane a fost realizată după șase minute de resuscitare cardiopulmonară. În timpul resuscitării s-a observat distensie abdominală crescută; prin urmare, a fost introdus un cateter urinar cu senzor de presiune. Presiunea maximă a căilor respiratorii și a vezicii urinare a fost măsurată la mai mult de 60 cmH2O și, respectiv, 50 mmHg. Chirurgia a fost apoi consultată. Un protocol masiv de Transfuzie a fost inițiat după ce rudele ei au fost de acord să permită transfuzia de produse din sânge. A fost efectuată o evaluare concentrată cu sonografie pentru traume (FAST), arătând lichid liber în punga lui Morrison. Pe măsură ce măsurile de resuscitare au fost continuate, s-a obținut un studiu suplimentar și s-a făcut un diagnostic.
discuție de caz
acest caz a prezentat o secvență unică și circuitată de evenimente care s-au spiralat foarte repede într-o direcție nefericită. Atunci când este prezentat pacienților care au plângeri vagi sau minime, este de datoria furnizorilor să caute indicii care să ajute la stabilirea diagnosticului. Prin urmare, am început prin a căuta indicii în acest caz.
pacientul a prezentat o plângere principală că are nevoie de dializă. Ea a fost recent internată într-o altă unitate pentru pneumonie și bacteremie și i s-a îndepărtat cateterul HD din cauza suspiciunii de sepsis de linie. Ea a semnat AMA din această facilitate după ce a primit daptomicină. Nu se știe cât timp a fost fără HD sau dacă și-a terminat tratamentul cu antibiotice înainte de a pleca. Cu toate acestea, ea este în esență asimptomatică.
istoricul ei medical trecut este notabil pentru convulsii, precum și TVP și anemie. Nu se menționează niciun medicament anticoagulant sau antiepileptic, ceea ce indică faptul că fie nu și-a amintit numele medicamentelor, fie nu a luat niciunul. De remarcat, ea este martoră a lui Iehova și, prin urmare, a primit terapii alternative pentru anemia ei, inclusiv fier, folat și epogen.
examenul fizic arată că este febrilă, dar cu semne vitale stabile. Mă așteptam la asta, având în vedere că a părăsit cealaltă unitate și probabil că nu și-a terminat cursul de antibiotice pentru pneumonie și bacteremie. Alte posibilități includ o infecție rezistentă la antibiotic sau o infecție nosocomială nou dobândită de la șederea anterioară în spital. Are niște sunete de respirație grosiere și trosnituri bibasilare la examenul pulmonar, ceea ce confirmă Istoricul pneumoniei. Pneumonia este cel mai probabil sursa febrei ei, precum și bacteremia, care poate să nu prezinte simptome.
studiile sale de laborator au relevat unele constatări pertinente. Era anemică și hiperkalemică. Ea a fost, de asemenea, hipocalcemică și hiperfosfatemică. Ea a avut unele uremie ușoară, de asemenea. Majoritatea acestor constatări ar fi oarecum așteptate la un pacient cu ESRD. Anemia poate fi rezultatul bolii renale. Alte posibilități privind diagnosticul diferențial pentru anemie includ hemoragie, deficit de fier, și deficit de acid folic. Ea nu se plânge de nicio pierdere de sânge și nici nu avem indicii globulelor roșii, cum ar fi volumul corpuscular mediu, pentru a putea face aceste diagnostice alternative în acest moment. Hiperkaliemia ei este cel mai probabil din cauza lipsei de HD. Hiperfosfatemia ei este, de asemenea, cel mai probabil din cauza lipsei de HD; cu toate acestea, daptomicina poate provoca și hiperfosfatemie.
în așteptarea plasării patului, ea a început HD în timpul căreia începe să se plângă de senzație de slăbiciune și se observă că devine hipotensivă și tahicardică. Apoi a inițiat CRRT și rămâne hipotensivă, devine hipoxică, nu răspunde și are o criză tonico-clonică care necesită intubare și inițiere vasopresoare. Examenul arată elevi egali și reactivi la un pacient care nu răspunde la stimuli dureroși. Studiile de laborator relevă o anemie profund agravată, agravarea hiperkaliemiei și dezvoltarea intervalului de acidoză lactică. Apoi intră într-un arest de mazăre și, după revenirea cu succes a circulației spontane, i s-a transfuzat sânge. Cu toate acestea, ea este încă hipotensivă și hipoxică în ciuda intubării. De asemenea, are un abdomen distins și presiuni maxime ale căilor respiratorii mai mari de 60 cmH2O. un examen rapid dezvăluie lichid liber în punga lui Morrison.
o astfel de schimbare profundă a statutului după o intervenție terapeutică necesită o gândire serioasă. Să începem cu hipotensiunea și tahicardia în timpul HD și CRRT ulterior. Hipotensiunea în timpul HD este cu siguranță posibilă cu debite mai mari. Cu toate acestea, CRRT are debite mult mai lente, iar hipotensiunea arterială este mai puțin frecventă atunci când se utilizează CRRT. Deci, de ce este această persoană în stare de șoc care necesită vasopresoare după inițierea HD?
când mă apropii de pacienții cu șoc, îmi vine în minte șocul mnemonic (septic/spinal; hipovolemic; obstructiv; cardiogen; anafilactic – K ca în lactic). Sepsisul este cu siguranță posibil, având în vedere istoricul ei de bacteremie. Cu toate acestea, este mai puțin probabil să fie cauza unei astfel de decompensări profunde, în special cu un debut acut în stabilirea HD de inițiere. Șocul hipovolemic sau hemoragic este o altă posibilitate. Ea are factori de risc pentru ambele ca ea poate fi pe anticoagulare cu istoria ei de TVP, precum și, eventual, având uremic trombocite defecțiune. Acest lucru va trebui investigat în continuare. Șocul obstructiv ca în embolismul pulmonar sau tamponada este o altă posibilitate. Ea are cu siguranță factori de risc pentru acest lucru cu istoria ei de TVP și statutul anticoagulare necunoscut. Ea este, de asemenea, hipoxică, ceea ce nu se explică prin pneumonie, deoarece saturațiile sale originale au fost peste 95%. De asemenea, ar fi putut dezvolta tamponadă din pericardită uremică, deși acest lucru este mai puțin probabil, având în vedere că azotul ureei din sânge (BUN) nu este semnificativ crescut și nu a avut plângeri de simptome de pericardită. O altă posibilă cauză a colapsului hemodinamic care duce la șoc obstructiv este o embolie aeriană din noul cateter HD și inițierea ulterioară a HD prin acesta. Pentru că acest lucru este posibil, trebuie să tachineze acest lucru un pic mai mult, de asemenea.
șocul cardiogen este mai puțin probabil, deoarece este puțin probabil să fi dezvoltat un infarct miocardic nedureros atât de sever încât a intrat în șoc cardiogen. Problemele anafilactice și endocrine sunt alte cauze posibile ale șocului. Cu toate acestea, nu s-au administrat medicamente sau nici o mențiune de erupție cutanată sau compromis căilor respiratorii pentru a sugera anafilaxie ca o cauză. Șoc endocrin ar trebui să fie luate în considerare ca ea este pe prednison, ceea ce face insuficiență suprarenală o posibilă cauză. Hiperkaliemia și hiponatremia pe care le-ați aștepta cu insuficiență suprarenală sunt prezente; cu toate acestea, nu există nici o mențiune de neconformitate sau vărsături de steroizi, ceea ce face această posibilitate mai puțin probabil.
sechestrarea în timpul HD este o altă entitate prezentă în acest caz. Ea are un istoric de convulsii, și nici un antiepileptic este pe lista ei de medicamente. Deci, sechestrul ei ar putea fi cu siguranță de la nerespectarea. Encefalopatia uremică se poate prezenta ca convulsii în orice moment; cu toate acestea, cocul este doar ușor ridicat, ceea ce face acest lucru puțin probabil. Sindromul de dezechilibru de dializă este o altă cauză a convulsiilor în timpul HD. Cu toate acestea, apare de obicei în timpul primei sesiuni HD și este asociată cu o scădere rapidă a bunului. Acest pacient a fost pe HD de ceva timp și cocul nu este semnificativ ridicat, ceea ce face ca acest diagnostic să fie puțin probabil. În cele din urmă, scăderea perfuziei la creier din cauza hipotensiunii arteriale în timpul HD poate induce convulsii. Pacientul a devenit hipotensiv în timpul HD, ceea ce se poate întâmpla din cauza debitelor mai mari. Apoi a fost plasată pe CRRT, care folosește un debit mai lent și are o incidență mult mai mică a hipotensiunii; cu toate acestea, ea a devenit mai hipotensivă. Acest lucru sugerează că există cel mai probabil un alt motiv pentru hipotensiune, mai degrabă decât pur și simplu HD.
de asemenea, are lichid liber la examenul rapid și acum are un abdomen distins. Cuplat cu agravarea profundă a anemiei, trebuie să presupun că sângerează în abdomen. Nu există nimic altceva decât hemoragie și hemoliză care ar putea explica o scădere atât de profundă a hemoglobinei și nu există dovezi care să fie suspecte de hemoliză în istoricul ei, examenul fizic sau studiile auxiliare.
pacientul se confruntă, de asemenea, cu presiuni ridicate ale căilor respiratorii asupra ventilatorului. Există mai multe motive pentru care presiunile căilor respiratorii ar putea fi ridicate; dar în stabilirea unui abdomen distins și hipotensiune arterială, sindromul compartimentului abdominal (ACS) vine în prim-planul diagnosticelor mele diferențiale. Prin urmare, trebuie să presupun că aceasta este o sângerare relativ rapidă, deoarece și-a scăzut semnificativ hemoglobina, a intrat în arest de mazăre, s-a îmbunătățit cu transfuzii de sânge și necesită mai mulți vasopresori pentru a-și menține tensiunea arterială. Dar de ce sângerează în abdomen? Nu a suferit nicio traumă a abdomenului decât dacă s-a întâmplat în timpul confiscării din spital; cu toate acestea, dacă ar fi fost cazul, aș presupune că această istorie ar fi fost dată. Cu siguranță ar fi putut experimenta un fel de catastrofă aortică, cum ar fi un anevrism aortic abdominal rupt, dar ar fi foarte ciudat ca acest lucru să se fi întâmplat în timpul HD.
acum a trebuit să fac un pas înapoi și să văd indicii de diagnostic ca un întreg și să pun aceste piese de puzzle împreună. Luând în considerare întreaga prezentare a pacientului, o temă comună apare în aproape fiecare aspect al secvenței sale de evenimente. Hemoragie. Anemie? Hemoragie. Anemia ei se agravează? Categoric hemoragie. Hipotensiune arterială? Hemoragie. Sechestru? Hipoperfuzia care provine din hipotensiune care provine din hemoragie. Hipoxie? Anemie profundă, care provine din hemoragie. ACS? Hemoragie. Acidoză lactică? Hipotensiune arterială și anemie din hemoragie.
acum trebuie doar să ne dăm seama de unde provine această hemoragie. Când pacienta s-a prezentat pentru prima dată, a apărut remarcabil de stabilă. Nu avea plângeri și semnele vitale, altele decât febra, erau în limite normale. Ea a avut un cateter HD plasat fără nici o mențiune de complicații. Începe HD și tensiunea arterială scade, ritmul cardiac crește și devine simptomatică aproape imediat. Aș putea da vina cu ușurință pe HD ca fiind cauza; cu toate acestea, furnizorii ei inițiază CRRT și hipotensiunea ei se înrăutățește, făcând HD mai puțin probabil să fie cauza. Prin urmare, ceva s-a întâmplat înainte de inițierea HD, deoarece ea a fost stabilă până la începerea HD. Singurul lucru care sa întâmplat înainte de inițierea HD a fost plasarea cateterului HD. Nu se menționează complicații sau pierderi semnificative de sânge în timpul plasării. Cu toate acestea, este singurul eveniment între pacientul stabil și instabil.
dacă nu s-ar fi menționat o complicație evidentă, ce s-ar fi putut întâmpla? Amintiți-vă că sursa presupusă a sângerării se află în abdomen. Cateterul HD a fost plasat în zona inghinală, care nu este departe de abdomen și spațiul retroperitoneal. Dacă furnizorul care plasează linia a pătruns în cealaltă parte a peretelui vasului, el/ea ar fi putut plasa cu ușurință cateterul HD, astfel încât vârful acestuia să fie în retroperitoneu. În acest caz, pacientul extravasează sângele în spațiul retroperitoneal provocând hipotensiune arterială, perfuzie scăzută, acidoză lactică și anemie profundă. Odată ce spațiul retroperitoneal s-a umplut, ar exista o presiune intraabdominală crescută care va duce în cele din urmă la ACS. O revizuire a literaturii relevă un raport de caz al acestui tip de complicație.1
prin urmare, studiul de diagnostic pe care l-aș efectua este o angiogramă de tomografie computerizată (CT) a abdomenului și a pelvisului. Acest lucru ar arăta unde a fost plasat cateterul HD și ar examina retroperitoneul pentru semne de sângerare activă.
rezultatul cazului
studiul de diagnostic a fost o angiogramă CT a abdomenului și pelvisului. Cateterul HD femural stâng a perforat vena iliacă comună stângă a pacientului și a format un hematom retroperitoneal pe partea dreaptă. Echipa chirurgicală a evaluat pacientul și a efectuat o laparotomie temporizantă pentru a-i trata ACS acut. Aceasta a relevat un hematom retroperitoneal mare, pe partea dreaptă și o cantitate mare de ascite. Hemodinamica pacientului s-a stabilizat după această procedură și a reușit să se desprindă de toate vasopresoarele. Apoi a fost transportată direct în sala de operație cu echipa de chirurgie vasculară pentru o reparație emergentă a venei iliace comune stângi.
a continuat să primească mai multe transfuzii de sânge în timpul reparației. Ulterior a fost transferată la UTI chirurgical cu un abdomen deschis care a fost ulterior reparat. Pacienta s-a trezit complet intactă din punct de vedere neurologic și a fost externată acasă la cinci săptămâni după accidentare.
discuție rezidentă
ACS este punctul final al unui spectru care începe cu hipertensiunea intraabdominală (IAH) și se termină atunci când presiunea intraabdominală depășește 20 mmHg și este însoțită de disfuncția organului final.2 presiunea abdominală normală, chiar și la pacienții cu afecțiuni critice, ar trebui să fie <12 mmHg. IAH, care poate fi clasificat în etape, este definit ca o presiune de 12-25 mmHg fără prezența disfuncției organelor.
există mai multe tipuri distincte de ACS. ACS primar apare în traume sau catastrofe chirurgicale care au ca rezultat un eveniment hemoragic mare, ca în cazul prezentat.3 ACS secundar apare atunci când pacienții cu ICU sunt resuscitați agresiv cu volume mari de cristaloizi.4,5 cauzele secundare mai puțin frecvente includ leziuni mari, care ocupă spațiu, edem intestinal sau retroperitoneal și pancreatită. SCA secundar este insidios și de obicei este diagnosticat după o întârziere, complicând și mai mult o mortalitate deja ridicată.4,5
letalitatea SCA se datorează perfuziei compromise a organelor și insuficienței ulterioare a organelor. În rinichi, scăderea perfuziei renale duce la congestie și oligurie, în timp ce creșterea presiunii compartimentului determină comprimarea directă a organului.6,7 creșterea rezistenței vasculare splanchnice are ca rezultat edemul intestinului, translocarea bacteriilor intestinale, hiperlactemia și sepsisul.6,7 preîncărcarea cardiacă poate fi redusă datorită comprimării venei cave inferioare, determinând scăderea debitului cardiac, în timp ce postîncărcarea ventriculului drept crește.7 oxigenarea este afectată pe măsură ce diafragma este împinsă cefalad și capacitatea reziduală funcțională scade.7 presiunea intracraniană crește, de asemenea, ca urmare a compresiei venoase jugulare care afectează revenirea venoasă. Din punct de vedere clinic, pacientul va prezenta hipotensiune arterială, hipoxie, leziuni renale acute, stare mentală modificată, convulsii sau lipsă de reacție; în cele din urmă, pacientul prezintă colaps cardiovascular total.6-8
standardul de aur pentru diagnosticul ACS este măsurarea presiunii vezicii urinare indirect cu un cateter urinar.9 pentru a măsura o presiune precisă, pacientul trebuie să se afle în poziția culcat pe spate și măsurarea efectuată la expirarea sfârșitului, cu traductorul la zero și în conformitate cu creasta iliacă. S-a demonstrat că această măsurare se corelează cu presiunea intraabdominală măsurată direct.10 măsurarea presiunilor vezicii urinare la fiecare 4-6 ore este adecvată la pacienții cu boli critice cu risc de a dezvolta ACS.
pilonul principal al tratamentului pentru SCA este laparotomia decompresivă, necesitând de obicei lăsarea pacientului cu un abdomen deschis postoperator.11 alte măsuri temporare secundare includ sedarea și analgezia, paralizia neuromusculară, decompresia conținutului intestinului cu un tub nazo – sau endogastric, diuretice și CRRT.11,12
mortalitatea SCA rămâne ridicată în ciuda intervenției medicale. În timp ce laparotomia decompresivă reduce efectiv imediat presiunea intraabdominală, această procedură este asociată cu multiple comorbidități medicale cu o mortalitate care rămâne până la 50%.13 Acest lucru se poate datora faptului că, în momentul laparotomiei decompresive, pacienții sunt bolnavi critic și procedura este considerată o ultimă soluție.
o a doua problemă majoră de discutat în acest caz este dilema etică cu care se confruntă furnizorii care îngrijesc acest pacient în stare critică ale cărui credințe religioase erau în opoziție cu tratamentul standard (transfuzia de produse sanguine) pentru boala ei. Pacientul a avut documentația inițială în graficul conversației medic-pacient în timpul căreia și-a declarat refuzul conștient de produse din sânge. Cu toate acestea, ea nu a scris, semnat documentația de produs din sânge-refuzul de transfuzie în diagramă. În timp ce pacienta era inconștientă și in extremis, soțul ei, care nu este martor practicant al lui Iehova, a inversat decizia ei în încercarea de a-i salva viața. Unde se încadrează această decizie în echilibrul autonomiei vs. puterea rudelor apropiate de a decide ce intervenții medicale ar trebui să primească un pacient? Ce se întâmplă atunci când rudele apropiate iau o decizie care este împotriva alegerii pacientului? În situații de viață sau de moarte cu dileme etice, în care luarea rapidă a deciziilor va decide rezultatul pacientului, cum poate fi pusă această povară asupra celor dragi?
dilema etică, prin urmare, constă în ideea că, în timp ce transfuzia încalcă valoarea autonomiei, ea îndeplinește simultan conceptul etic de binefacere. În general, directivele personale ale pacienților ar trebui să aibă prioritate față de orice decizie luată de mandatarul medical. Cu toate acestea, decizia familiei de a face transfuzie în numele pacientului inconștient, așa cum se vede în cazul actual, este adecvată din punct de vedere legal, chiar dacă încalcă autonomia pacientului.
Comitetul de etică a fost consultat după ce pacientul a primit deja o transfuzie masivă de produse din sânge și a continuat să primească transfuzii suplimentare de globule roșii. Comitetul a recomandat ca pacientul să nu mai primească transfuzii de produse din sânge, în ciuda consimțământului rudelor apropiate. Pacientul s-a trezit complet intact din punct de vedere neurologic și a fost informat despre transfuziile de sânge. Ea a decis că în viitor va accepta doar plasma băncii de sânge și globulele roșii donate de familie în timpul unui eveniment acut. Pacientul a fost externat acasă la cinci săptămâni după rănirea iatrogenă.
diagnostic FINAL
perforarea venei iliace comune stângi iatrogene cu sindromul compartimentului abdominal rezultat.
puncte cheie de predare
ACS apare atunci când presiunea intraabdominală este peste 20 mmHg și sunt prezente leziuni ale organelor finale.
SCA primară este cauzată de traume sau intervenții chirurgicale, dar fiți atenți la SCA secundară observată în resuscitarea masivă, în special în UCI.
standardul de aur al diagnosticului ACS este o presiune măsurată a vezicii urinare.
tratamentul este o laparotomie, precum și măsuri de temporizare, cum ar fi evacuarea conținutului intestinal și/sau sedarea și paralizia.
consimțământul informat documentat al pacientului și/sau aprobarea Consiliului de revizuire instituțională au fost obținute și depuse pentru publicarea acestui raport de caz.
Note De Subsol
Editor De Secțiune: Rick A. McPheeters, DO
text complet disponibil prin acces deschis la http://escholarship.org/uc/uciem_cpcem
adresa pentru corespondență: Laura J. Bontempo, MD, MEd, Universitatea din Maryland, Departamentul de Medicină de urgență, 110 S Paca Street, etajul 6, Suite 200, Baltimore, MD 21201. E-mail: [email protected]. 2:103 – 108
Istoricul depunerii: revizuirea primită la 22 ianuarie 2018; depusă la 19 martie 2018; acceptată la 21 martie 2018
conflicte de interese: Prin acordul de depunere a articolului CPC-EM, toți autorii sunt obligați să dezvăluie toate afilierile, sursele de finanțare și relațiile financiare sau de management care ar putea fi percepute ca surse potențiale de părtinire. Autorii nu au dezvăluit nimic.
1. Pafitanis G, Spyridon K, Theodorakopoulou E și colab. Un raport de caz al sindromului compartimentului abdominal cauzat de malpoziția unui cateter venos femural. Int J Surg Caz Rep. 2015; 12: 84-6.
2. Maluso P, Olson J, Sarani B. hipertensiunea compartimentului Abdominal și sindromul compartimentului abdominal. Crit Îngrijire Clin. 2016;32(2):213-22.
3. Morken J, West MA. Sindromul compartimentului Abdominal în unitatea de terapie intensivă. Curr Opin Crit Îngrijire. 2001;7(4):268-74.
4. Biffl WL, Moore EE, Burch JM și colab. Sindromul compartimentului abdominal secundar este un eveniment extrem de letal. Am J Surg. 2001; 182 (6):645-8.
5. Burrows R, Edington J, Robbs JV. Un lup în îmbrăcămintea lupului: sindromul compartimentului abdominal. S Afr Med J. 1995; 85 (1): 46-8.
6. Caldwell CB, Ricotta JJ. Modificări ale fluxului sanguin visceral cu presiune intraabdominală crescută. J Surg Res. 1987; 43 (1):14-20.
7. Balogh Z, McKinley BA, Cox CS și colab. Sindromul compartimentului Abdominal: cauza sau efectul insuficienței multiple a organelor postinjurice. Șoc. 2003;20(6):483-92.
8. Vidal MG, Ruiz Weisser J, Gonzalez F și colab. Incidența și efectele clinice ale hipertensiunii intraabdominale la pacienții cu afecțiuni critice. Crit Care Med. 2008;36(6):1823-31.
9. Kron IL, Harman PK, Nolan SP. Măsurarea presiunii intraabdominale ca criteriu pentru reexaminarea abdominală. Ann Surg. 1984; 199 (1):28-30.
10. Saggi BH, Sugerman HJ, Ivatury RR și colab. Sindromul compartimentului Abdominal. J Trauma. 1998;45(3):597-609.
11. Kirpatrick AW, Roberts DJ, De Waele JD și colab. Hipertensiunea intraabdominală și sindromul compartimentului abdominal: definiții concensus actualizate și ghiduri de practică clinică de la Societatea Mondială a sindromului compartimentului Abdominal. Terapie Intensivă Med. 2013;39(7):1190-206.
12. Ouellet JF, Leppaniemi A, Ball CG și colab. Alternative la decompresia abdominală formală. Am Surg. 2011; 77(Sl): S51-7.
13. De Waele JJ, Hoste EA, Malbrain ML. Laparotomie decompresivă pentru sindromul compartimentului abdominal–o analiză critică. Crit Care. 2006; 10(2): R51.