Introducere
factorul Kruppel-like 4 (KLF4) este un membru al familiei factorului de transcripție zinc-deget,care este exprimat în diferite țesuturi umane. Este bine cunoscut ca unul dintre cei patru factori ai inducției la celulele stem pluripotente (IPSC) (Ghaleb și Yang, 2017). KLF4 poate regla mai multe procese biologice importante, cum ar fi neuroinflamația, stresul oxidativ, proliferarea, diferențierea și apoptoza (Kaushik și colab., 2010; Mamonkin și colab., 2013; Zhang și colab., 2015; Miao și colab., 2017; Xu și colab., 2017). Cantități de studii anterioare s-au concentrat asupra rolului KLF4 în dezvoltarea și progresia cancerului (Karam și colab., 2017; Yadav și colab., 2018). KLF4 este un factor de transcripție cu funcție dublă, care își poate exercita rolul de oncogen sau genă supresoare tumorală în funcție de tipul de cancer sau de stadiul cancerului (Evans și Liu, 2008). Poate activa sau inhiba transcrierea genelor implicate în proliferarea, diferențierea și apoptoza celulelor (Ding și colab., 2015). KLF4 poate colabora cu alți factori de reprogramare pentru a converti celulele somatice în IPSC și a inhiba diferențierea celulelor stem (Takahashi și Yamanaka, 2006; van Schaijik și colab., 2018). Aceasta oferă perspective terapeutice pentru bolile vasculare, bolile imune, anorexia și alte boli (Imbernon și colab., 2014; Liu Y. și colab., 2015; Murgai și colab., 2017). Mai mult, KLF4 poate juca un rol larg de reglementare în sistemul nervos central (SNC). Mai multe studii indică faptul că KLF4 este legat de multiple tulburări neurologice, inclusiv boala Alzheimer (AD), epilepsie, boala Parkinson, hidrocefalie și schizofrenie (Qin și colab., 2011; Xie și colab., 2013; Han și colab., 2015; Nishiguchi și colab., 2015; Li L. și colab., 2017).
AD este una dintre cele mai frecvente boli neurodegenerative cronice, ceea ce duce la tulburări cognitive și de memorie, diverse simptome mentale și anomalii comportamentale, iar demența progresivă este cea mai frecventă caracteristică clinică (Jiang și colab., 2018). Factorii patogeni actuali confirmați ai AD includ formarea plăcilor senile induse de depunerea anormală a amiloidului-inkt (a inkt) și încurcăturile neurofibrilare sau nevrita distrofică indusă de acumularea tau (Querfurth și LaFerla, 2010; Shinohara și colab., 2014). În plus, AD poate fi afectat și de factori genetici. Cu toate acestea, patogeneza provocată este încă obscură. Cele mai răspândite medicamente pentru tratamentul AD includ potențiatori de neurotransmițători, agenți anti-Amiloizi, peptide neuroprotectoare și alte medicamente (Cacabelos, 2018). În special, mai multe studii au arătat că KLF4 a jucat un rol semnificativ în patogeneza AD. În această revizuire, ne concentrăm asupra rolului de reglementare al KLF4 în neuroinflamația, apoptoza neuronală, regenerarea axonală și acumularea de fier pentru a explica asocierea dintre KLF4 și patogeneza AD, care ar putea oferi informații despre mecanismele celulare și moleculare ale tulburărilor neurodegenerative.
caracteristicile biologice ale KLF4
KLF4 este o proteină nucleară care conține degetul de zinc, izolată din biblioteca NIH 3T3 și localizată în nucleul celular. A fost identificat și caracterizat pentru prima dată de Shields și colab. (1996). Masa moleculară a KLF4 umană este de 55kD și este localizată pe cromozomul 9q31. KLF4 acoperă un segment de gene de 6,3 kb și are cinci exoni. Regiunea sa de codificare ADNc codifică o polipeptidă formată din 470 reziduuri de aminoacizi (totuși și colab., 1998; Ghaleb și Yang, 2017). Capătul carboxi al KLF4 are o regiune de structură de legare a ADN-ului care conține trei structuri de deget de zinc de tip Cys2His2 (C2H2), care sunt formate din 81 de aminoacizi foarte conservați. Reglează transcrierea prin afinitate ridicată cu elementele CACCC și secvențele ADN ale genei țintă bogate în GC (Shields și Yang, 1998; Pearson și colab., 2008). Majoritatea siturilor de legare a ADN-ului KLF4 sunt situate în regiunea degetului de zinc, inclusiv domeniul de activare a transcripției n-terminale pentru interacțiunea proteinelor, structura degetului de zinc C-terminal pentru legarea ADN-ului și zona de inhibare a transcripției (Bieker, 2001). KLF4 este implicat în reglarea expresiei multor gene endogene (Shields și Yang, 1998). Există un domeniu de reglementare transcripțional foarte variabil la capătul amino al KLF4. Reziduurile de aminoacizi situate între 91 și 117 amino constituie un domeniu de activare transcripțională, care este bogat în prolină și serină, în timp ce există și un domeniu de represiune transcripțională. Prin urmare, KLF4 are două efecte adverse: activarea și inhibarea transcripției genice (totuși și colab., 1998; Wei și colab., 2006).
în timpul dezvoltării embrionare, KLF4 a fost exprimat mai mult în stadiul final al dezvoltării embrionare. În timp ce în țesuturile și organele mature, KLF4 este exprimat în principal în tractul gastro-intestinal, cavitatea bucală, epiderma pielii, endoteliul vascular și rinichii și este mai puțin exprimat în creier (Segre și colab., 1999; Ghaleb și colab., 2011; Liu și colab., 2013; Chen și colab., 2015; el și colab., 2015; Bin și colab., 2016). Se crede că joacă un rol semnificativ în reglarea proliferării și diferențierii celulare. În plus, KLF4 poate regla și ciclul celular. KLF4 poate activa P21 într-o manieră dependentă de P53 (Zhang și colab., 2000). În plus, s – a constatat că celulele KLF4 ( – / – ) au intrat în faza de senescență mai devreme decât celulele KLF4 ( + / + ), ceea ce poate fi explicat prin expresia genelor mai puțin antioxidante și nivelul mai ridicat al speciilor reactive de oxigen (ROS) în celulele KLF4 ( – / -). ROS poate crește expresia p53 și p21 și, ulterior, poate promova deteriorarea ADN-ului (Liu C. și colab., 2015). S-a constatat că PRMT5 poate ridica expresia KLF4 în nivelurile de proteine. S-a raportat că PRMT5 crește transcrierea p21 și scade expresia bax prin inhibarea ubiquitilării KLF4 (Hu și colab., 2015). Mai mult, numeroase studii au demonstrat că KLF4 este implicat în reglarea apoptozei neuronilor (Kong și colab., 2016; Cui și colab., 2017; Song și colab., 2018). Rolul de reglementare fiziologică a KLF4 pe care le-am cunoscut sunt încă puține și sunt necesare investigații suplimentare.
rolul KLF4 în AD
este bine stabilit că AD se caracterizează în principal prin tulburări de memorie și cognitive și disfuncție executivă (Goedert și Spillantini, 2006). Multe studii au demonstrat că apoptoza neuronală și disfuncția sinaptică sunt baza patologică a declinului funcției cognitive (Caccamo și colab., 2017; Guo și colab., 2017; Yoon și colab., 2018). Deteriorarea acumulata a unei depuneri de fier, stresul oxidativ si acumularea de fier pot duce la disfunctii neuronale si apoptoza pacientilor cu AD. Mai multe studii au arătat că rolul de reglementare al KLF4 pare a fi crucial în SNC. Având în vedere că s-a raportat că KLF4 reglează apoptoza neuronală, regenerarea sinaptică, stresul oxidativ și neuroinflamația, relația dintre KLF4 și patogeneza AD ar putea fi o țintă potențială nouă pentru tratamentul AD.
rolul KLF4 în Neuroinflamația
cantități de studii clinice au arătat că un implant poate agrega și este componenta principală a depozitelor extracelulare ale țesutului cerebral al pacienților cu AD, care pot afecta sinapsele și neuronii din jur și pot duce la moartea neuronală. Secretia anormala sau producerea excesiva a unui Centimetr duce la modificari patologice ale AD, deci o depunere de Centimetrie este veriga de baza a Ad (Rajmohan si Reddy, 2017). In plus, studiile au aratat ca depunerea excesiva a unui procent poate stimula celulele gliale sa secrete ROS si alti factori de influenta, ceea ce duce la stres oxidativ. S-a știut că stresul oxidativ poate stimula producerea unui sec. Prin urmare, un stres oxidativ și oxidativ poate interacționa unul cu celălalt și poate afecta progresia AD (Cheignon și colab., 2018).
KLF4 a fost raportat ca un modulator potențial și are un efect deosebit asupra inflamației prin medierea macrofagelor și a celulelor endoteliale (Figura 1) (Yoshida și colab., 2014; Kapoor și colab., 2015; Yang și colab., 2018). În SNC, reacțiile inflamatorii excesive și cronice pot provoca leziuni ale neuronului și neurogliocitelor. S-a demonstrat recent că expresia KLF4 s-a corelat pozitiv cu o neuroinflamație indusă de Centicl42. În celulele microgliale BV2, oligomericul a Xv42 poate crește expresia KLF4, care este mediată de p53 activat (Li L. și colab., 2017). În condiții inflamatorii, cum ar fi o acumulare de centi, eliberarea citokinelor pro-inflamatorii poate fi stimulată în generarea de AD (Griffin și Barger, 2010). Neurotoxicitatea potența și potența pro-inflamatorie a oligomerilor solubili a Inq42 este relativ mai mare decât depozitul de fibre insolubile (Selkoe, 1991; Weinberg și colab., 2018). Tăcerea lui KLF4 este capabilă să restabilească o neuroinflamație mediată de x42, iar supraexprimarea KLF4 poate exacerba o neuroinflamație mediată de x42 (Li L. și colab., 2017). O acumulare de centimetrii induce activarea astrocitelor și microgliilor(Rodriguez și colab., 2016). Astrocitele activate pot spori neuroinflamația prin eliberarea unor factori pro-inflamatori precum IL-1, IL-6 și TNF-colosc (Rubio-Perez și Morillas-Ruiz, 2012; Dom., 2016). Ciclul vicios al răspunsurilor inflamatorii duce în cele din urmă la disfuncție și apoptoză neuronală.
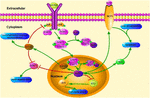
FIGURA 1. Schematicilustrarea căilor de semnalizare legate de KLF4. Această cifră evidențiază rolul KLF4 în neuroprotecția și regenerarea axonilor. Săgețile din figură indică activarea sau promovarea, iar liniile drepte indică inhibarea asociată. KLF4, factor asemănător Kruppel 4; STAT3, Traductor de semnal și activator al transcripției 3; JAK, Janus kinază; SOCS3, supresor al semnalizării citokinelor 3; HCP1, proteină purtătoare heme 1; ERK5, proteină kinază activată cu mitogen 5.
KLF4 joacă un rol crucial în reglarea semnalelor pro-inflamatorii. În celulele gliale, activarea KLF4 indusă de gemfibrozil crește supresorul semnalului de citokină 3 (SOCS3) prin calea PI3-kinază-AKT (Ghosh și Pahan, 2012). Eliminarea mediată de SiRNA a KLF4 ar putea atenua nivelul soc-urilor în astroglia și microglia șoarecilor, ceea ce ar putea afecta ulterior expresia genei inflamatorii (Kaushik și colab., 2010; Ghosh și Pahan, 2012). În plus, ștergerea soc poate promova supraviețuirea neuronilor răniți și poate promova regenerarea axonilor (Smith și colab., 2009; Sun și colab., 2011). Și KLF4 reglează pozitiv producția de IL-1 inkt sau alți markeri pro-inflamatori. Reglează pozitiv ciclooxigenaza-2 (Cox-2) și reglează negativ sintaza de oxid nitric inductibil (inos) (Kaushik și colab., 2013). În plus, KLF4 este un factor important de reglementare pentru diferențierea monocitelor și o țintă potențială pentru reglarea imunității (Alder și colab., 2008). Prin urmare, KLF4 ar putea promova neuroinflamația prin reglarea acestor regulatori negativi.
merită menționat faptul că în modelul bolii Parkinson, KLF4 poate promova stresul oxidativ și neurotoxicitatea induse de MPP+, apoi crește apoptoza neuronală și întârzie proliferarea celulelor (Chen și colab., 2013). Stresul oxidativ este un dezechilibru între peroxidare și antioxidare. Radicalii liberi pot provoca modificări în diferite macromolecule, ducând la deteriorarea celulelor, îmbătrânirea celulelor și deteriorarea țesuturilor (Parajuli și colab., 2013; Nie și colab., 2015). Stresul oxidativ poate agrava inflamația precoce și o producție de Centimetrie și apoi poate agrava AD (Cai și colab., 2011). Prin urmare, KLF4 poate fi implicat în stresul oxidativ în AD.
aceste constatări implică KLF4 un rol cheie în medierea neuroinflamării prin activarea microgliei și, în consecință, eliberarea citokinelor proinflamatorii. Are potențialul de a spori neuroinflamația. Până în prezent, multe studii privind patogeneza AD s-au concentrat asupra neuroinflamării. Ca țintă potențială pentru reglarea imunității, KLF4 poate promova răspunsurile inflamatorii ale microgliei prin afectarea regulatorilor negativi aferenți, ceea ce are un efect deosebit asupra dezvoltării AD.
rolul KLF4 în apoptoza
modificările Neurodegenerative includ pierderea treptată a neuronilor și sinapselor în regiunile reprezentative ale creierului, cum ar fi cortexul cerebral, hipocampul și alte regiuni subcorticale. Deficiențele funcționale ale SNC induse de pierderea neuronală sunt permanente (Citron, 2010). Stresul oxidativ susținut poate duce la apoptoza neuronală (Wu și colab., 2010). Un număr mare de studii au confirmat că AD este strâns legată de stresul oxidativ (Lee și colab., 2012; Yui și colab., 2015). S-a constatat că stresul oxidativ cronic poate spori expresia fosfolipazei A2 grupa 3 (Pla2g3) în astrocite și poate perturba echilibrul unui Inkst și, prin urmare, poate duce la dezvoltarea AD (Yui și colab., 2015).
multe studii au demonstrat că KLF4 joacă un rol important în inhibarea dezvoltării stresului oxidativ (Shi și colab., 2014; Liu C. și colab., 2015). Sa constatat că KLF4 poate promova apoptoza celulelor induse de H2O2, această acțiune este probabil să fie cauzată de creșterea expresiei bax și scăderea expresiei bcl-2 (Li și colab., 2010). Quercetina ar putea reduce expresia KLF4 în celulele neuroblastomului uman SH-SY5Y și ar putea crește expresia raportului bcl-2/bax. Mai mult, quercetina poate modera rata de apoptoză a celulei SH-5ysy și poate reduce activitatea enzimei caspase-3 (Xi și colab., 2012). Un studiu recent a investigat efectul neuroprotector al proteinei activate de mitogen (MAP) kinaza 5 (ERK5) împotriva stresului oxidativ. Activarea ERK5 poate reduce parțial moartea neuronilor hipocampali induși de H2O2 și poate crește neuroprotecția indusă de NGF și PC (Su și colab., 2014). Nils și colab. a folosit un mutant de MEK5 (MEK5D) pentru a studia transcripția activată de ERK5 și răspunsurile funcționale în celulele endoteliale umane și a identificat KLF4 a fost o nouă țintă erk5 în aval (Ohnesorge și colab., 2010). S-a constatat că supraexprimarea KLF4 poate suprima răspunsurile inflamatorii mediate de TNF și poate reduce aderența leucocitelor și apoptoza celulelor bazale. Aceste rezultate confirmă faptul că KLF4 are proprietăți antiinflamatorii și anti-apoptotice (Ohnesorge și colab., 2010). Experimentele ulterioare au demonstrat că dispariția malformației cavernoase cerebrale 1 (CCM1) în celulele endoteliale activează ERK5 prin calea semnalului MEKK3-MEK5 și crește expresia KLF4 (Cuttano și colab., 2016). ERK5 joacă un rol de mediere în precondiționare (PC) și factorul de creștere a nervilor (NGF) a reglat expresia KLF4 (Su și colab., 2014). În plus, eliminarea KLF4 mediată de RNAi poate reduce, de asemenea, neuroprotecția indusă de NGF sau PC. Supraexprimarea KLF4 duce la un raport bcl-2/bax mai mare în celulele stresate H2O2 (Su și colab., 2014). KLF4 supraexprimat accelerează schimbările în bcl-2 și bax prin combinarea cu promotorul său corespunzător (Li și colab., 2010). Cascada ERK5 / KLF4 poate acționa ca un pivot în diferite căi care protejează neuronii de moartea indusă de stresul oxidativ (Su și colab., 2014).
stresul oxidativ a fost considerat a fi strâns legat de multe boli degenerative. KLF4 joacă un rol semnificativ în menținerea stabilității genomice în stresul oxidativ. KLF4 și ERK5 acționează împreună pentru a proteja neuronii de apoptoza indusă de stresul oxidativ. Prin urmare, KLF4 poate acționa ca o țintă terapeutică pentru a acționa împotriva stresului oxidativ atunci când este activat. S-a raportat că medicamentele cu statină pot activa ERK5, ducând la exprimarea KLF4 și a genelor sale dependente (Ohnesorge și colab., 2010), dar mecanismul rămâne neclar, iar genele țintă legate de KLF4 în amonte și în aval sunt mai puțin studiate în stresul oxidativ, este nevoie de studii suplimentare.
rolul KLF4 în regenerarea axonilor
pierderea timpurie a axonilor este o caracteristică comună a bolilor neurodegenerative. Pierderea sinaptică și afectarea transportului în AD pot provoca tulburări cognitive (Holtzman și colab., 2011; Coleman, 2013). Gradul de deteriorare a memoriei declarative este legat de densitatea sinaptică din hipocamp și cortex. Oligomerii solubili a la sută reduc absorbția glutamatului și promovează disfuncția sinaptică, perturbând plasticitatea sinaptică (Li și colab., 2009). Prin urmare, este deosebit de important să studiem modul de reparare a axonilor din SNC. În celulele ganglionare retiniene, axonii au o capacitate puternică de a crește și de a se regenera în timpul dezvoltării timpurii, dar în SNC-ul mamiferelor adulte, axonii își pierd capacitatea de regenerare, iar neuronii pot absolvi să moară sau să se atrofieze (Goldberg și Barres, 2000; Goldberg și colab., 2002).
KLF4 joacă un rol important în inhibarea creșterii axonilor. În RGC-urile embrionare, supraexprimarea KLF4 poate reduce procentul de alungire a neuritei, lungimea axonilor și dendritelor și ramificarea neuritei. În plus, s-a constatat că supraexprimarea KLF4 poate reduce ratele de creștere a axonilor postnatali pe termen lung, dar nu a reușit să reducă ratele de creștere a axonilor pe termen scurt (Moore și colab., 2009; Steketee și colab., 2014). Studiile ulterioare au descoperit că mănunchiurile axonice ale șoarecilor KLF4–cKO au fost mai groase decât șoarecii de control (Fang și colab., 2016). În plus, eliminarea expresiei KLF4 în timpul dezvoltării poate crește potențialul de reproducere al RGC-urilor adulte. În plus, KLF4 lipsit de domeniul de legare a ADN-ului C-terminal nu a avut niciun efect asupra creșterii axonilor. Nu a existat niciun impact asupra supraviețuirii celulelor după ce celulele ganglionare retiniene au fost rănite dacă KLF4 a fost eliminat (Moore și colab., 2009).
KLF4 poate afecta și regenerarea axonală. Un studiu recent a raportat că scăderea expresiei KLF4 în celulele ganglionare retiniene adulte a promovat regenerarea axonilor prin calea JAK-STAT3 (Qin și colab., 2013). KLF4 a crescut fosforilarea STAT3 și a reglementat creșterea axonului prin semnalizarea JAK-STAT (Qin și Zhang, 2012). Sub tratamentul citokinelor, membrii familiei STAT de proteine sunt fosforilați la situsurile carboxi-terminale ale tirozinei și serinei din celulă pentru a forma un dimer stabil. Această modificare îmbunătățește transcrierea genelor asociate celulelor (Yuan și colab., 2005). Interacțiunea dintre KLF4 și STAT3 asupra fosforilării tirozinei induse de citokine705 inhibă expresia STAT3 prin inhibarea legării STAT3 de ADN (Qin și colab., 2013). Klf4 knockdown îmbunătățește în mod evident regenerarea axonului în celulele ganglionare retiniene după rănirea nervului optic și previne rănirea nervului după leziuni cerebrale ușoare. Acțiunile sunt mediate de o scădere a p-p53 și o creștere a nivelurilor pSTAT3. KLF4 reglează pozitiv apoptoza neuronală prin căile p53 și JAK-STAT3, iar KLF4 reglează negativ repararea axonală prin calea JAK-STAT3 (Cui și colab., 2017).
prin urmare, am emis ipoteza că în AD, regenerarea axonală poate fi realizată prin modificarea expresiei KLF4 sau modificarea căilor de semnalizare legate intracelulare și controlul progresiei AD prin reducerea axonilor lipsă sau reducerea disfuncției axonale. Cu toate acestea, modul de utilizare a factorului de transcripție KLF4 în terapia potențială necesită încă o explorare suplimentară.
rolul KLF4 în acumularea de fier
fierul se găsește pe scară largă în sistemele biologice, metaloproteinazele legate de fier joacă un rol cheie în transportul oxigenului, transferul electronilor și catalizarea reacțiilor biochimice (Aisen și colab., 2001). Cu toate acestea, orice exces de fier dincolo de intervalul fiziologic normal poate dăuna sănătății umane (Adlard și Bush, 2006). Studiile au descoperit că conținutul de fier din hipocamp este corelat negativ cu performanța testelor de memorie (Ding și colab., 2009). Creșterea încărcăturii de fier în creier accelerează formarea unei plăci de la sută și a încurcăturilor tau hiperfosforilate, sporind în același timp stresul oxidativ (Peters și colab., 2015). Fierul, care are un grad ridicat de permeabilitate, promovează creșterea nervilor și conexiunile celulă-celulă în timpul dezvoltării creierului (Dallman și Spirito, 1977).
un studiu recent a demonstrat că stresul fiziologic a provocat activarea căii de semnalizare KLF4-HCP1 și creșterea absorbției hem (Li H. și colab., 2017). Heme reprezintă 95% din fierul funcțional din corpul uman. Este una dintre componentele principale ale oxigenazei heme (Hooda și colab., 2014; Kurucz și colab., 2018). Creșterea activității oxigenazei – 1 poate întârzia oxidarea creierului îmbătrânit (Verdile și colab., 2015; Serini și Calviello, 2016; Kurucz și colab., 2018). Acest lucru are un efect de relief asupra AD. Stresul fiziologic induce creșterea nivelului glucocorticoizilor, glucocorticoidul crește expresia proteinei purtătoare de hem 1 (HCP1) prin KLF4, iar apoi HCP1 promovează absorbția hem (Li H. și colab., 2017). Glucocorticoidul și KLF4 reglează genele antiinflamatorii împreună, iar celulele cu conținut scăzut de glucocorticoizi nu pot induce complet expresia KLF4 (Sevilla și colab., 2015). Creșterea indusă de KLF4 a aportului de hem duce la acumularea de fier în creier. Fierul promovează eliberarea ROS (Tronel și colab., 2013). Elementul de fier îmbunătățește stresul oxidativ al creierului la șobolani sub stres psihologic (Yu și colab., 2011). Prin urmare, HCP1 poate fi reglat de KLF4 și glucocorticoid împreună. Creșterea HCP1 îmbunătățește absorbția hemului, ceea ce duce direct la acumularea de fier în creier, exacerbează oxidarea, crește apoptoza sau disfuncția și agravează leziunile cerebrale.
este general acceptat faptul că memoria și dizabilitatea de învățare sunt principalele simptome ale AD. Un număr mare de date clinice au arătat că un răspuns de încărcare a plăcii și acumularea de fier la dezvoltarea învățării și disfuncției cognitive în AD (van Bergen și colab., 2018). Datele publicate recent au sugerat că, doza mare de fier crește o depunere de un sfert și atenuează învățarea și memoria la șoareci (Guo și colab., 2013). Studiile clinice au arătat că microglia care conține fier se găsește în hipocampul pacienților cu AD sub imagistică prin rezonanță magnetică (Zeineh și colab., 2015). Microglia dobândește fier din surse transferante sau netransferante, extracelulare și intracelulare (McCarthy și colab., 2018). Expresia KLF4 selectivă și susținută poate fi indusă în nucleul și citoplasma astrocitelor reactive hipocampice ischemice (Park și colab., 2014). Studiile au arătat că KLF4 acționează ca un represor transcripțional. Reglează în jos expresia ELK-3, iar apoi ELK-3 inhibă expresia HO-1 (Tsoyi și colab., 2015). Heme oxigenaza-1 (HO-1) este o proteină de stres care degradează heme în bilirubină, fier liber și monoxid de carbon. Reglarea în sus a HO-1 în astrocite poate duce la depunerea anormală a fierului și la disfuncția mitocondrială în creier, ceea ce duce la scăderea capacității cognitive (Schipper, 1999, 2004). Prin urmare, KLF4 poate fi implicat în procesul de acumulare a fierului în astrocite, exacerbând oxidarea în AD și agravând leziunile cerebrale.
concluzie
KLF4 este cunoscut în mod obișnuit că joacă un rol esențial în reglarea proliferării celulare, a apoptozei și a diferențierii. Studiile anterioare s-au concentrat pe reglarea KLF4 în mai multe procese neurofiziologice importante, inclusiv neuroinflamația, neuroprotecția și regenerarea sinaptică. Recent, sa constatat că KLF4 joacă un rol important în patogeneza AD. În acest articol, analizăm rolul KLF4 în neuroprotecție și neurogeneză în AD.
KLF4 nu este doar un regulator al reglării proliferării și diferențierii celulare, ci și o țintă potențială pentru reglarea răspunsurilor imune. KLF4 poate regla factorii inflamatori negativi și poate promova răspunsul inflamator și poate avea un efect deosebit asupra expresiei microgliei nucleare astrocite. În plus, KLF4 și ERK5 pot acționa împreună pentru a exercita acțiuni neuroprotectoare. Mai mult, regenerarea axonilor poate fi realizată prin modificarea conținutului de factori de transcripție specifici, inhibitori intracelulari sau modificarea căilor de semnalizare intracelulară. Eliminarea KLF4 poate îmbunătăți regenerarea axonului și poate accelera rata de creștere a axonului. Reducerea expresiei KLF4 promovează regenerarea axonilor prin calea JAK-STAT3, iar KLF4 promovează calea JAK-STAT3 pentru a continua regenerarea axonilor. Prin urmare, KLF4 ar putea fi implicat în procesul de regenerare antiinflamatoare, anti-apoptoză, axon și acumulare de fier în SNC, care joacă un rol esențial în generarea AD. Aceste constatări sugerează că KLF4 reprezintă o țintă terapeutică potențială pentru AD. Cu toate acestea, mecanismele celulare și moleculare profunde ale efectelor KLF4 asupra AD rămân neclare și sunt necesare investigații suplimentare.
contribuții ale autorului
ZQC, XHZ și YJ au scris manuscrisul. SHG și JYL au modificat cadrul manuscrisului. BJL și RJC au furnizat revizuirile critice. Toți autorii au aprobat versiunea finală a manuscrisului pentru depunere.
finanțare
această lucrare a fost susținută de granturi de la Fundația pentru științe Naturale din China (NSFC) (81871070, 31571126, 31471120) și finanțarea Agenției pentru știință și Tehnologie Jilin (Grant Nr.20180519003jh, 20180414051GH, 20170414034gh și 20180414050gh).
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Cacabelos, R. (2018). Au existat îmbunătățiri în descoperirea de droguri boala Alzheimer în ultimii 5 ani. Exp. Opin. Droguri Discov. 13, 523–538. doi: 10.1080/17460441.2018.1457645
PubMed rezumat / CrossRef Text Complet / Google Scholar
Liu, Y., Shi, J. și Chen, X. (2015). Identificarea țintelor noi pentru rinita alergică sezonieră în timpul și în afara sezonului de polen prin analiza microarray. Acta Otolaringol. 135, 1330–1336. doi: 10.3109/00016489.2015.1067906
PubMed rezumat / CrossRef Text Complet / Google Scholar
Serini, S. și Calviello, G. (2016). Reducerea stresului oxidativ / nitrozativ în creier și implicarea acestuia în efectul neuroprotector al N-3 PUFA în boala Alzheimer. Curr. Alzheimer Res. 13, 123-134. doi: 10.2174/1567205012666150921101147
PubMed rezumat / CrossRef Text Complet / Google Scholar