nume Generic: polistiren sulfonat de sodiu
forma de dozare: pulbere orală, rectală
medical revizuite de Drugs.com. Ultima actualizare la 21 septembrie 2020.
- Prezentare generală
- efecte secundare
- dozare
- profesional
- interacțiuni
- mai mult
- pulbere de Kalexat descriere
- pulbere de Kalexat – Farmacologie Clinică
- indicații și utilizare pentru pulberea de Kalexat
- contraindicații
- avertismente
- Precauții
- interacțiuni medicamentoase
- mamele care alăptează
- utilizare pediatrică
- reacții Adverse
- supradozajul
- doza și administrarea de pulbere de Kalexat
- cum se furnizează pulbere de Kalexat
- eticheta pachetului.Panou principal de afișare
- mai multe despre Kalexat (polistiren sulfonat de sodiu)
- resurse pentru consumatori
- resurse profesionale
- ghiduri de tratament conexe
pulbere de Kalexat descriere
polistiren sulfonat de sodiu, USP, este un benzen, dietenil-polimer, cu etenilbenzen, sulfonat, sare de sodiu și are următoarea formulă structurală:
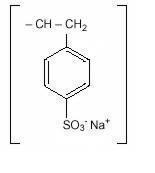
medicamentul este o cremă până la maro deschis fin măcinată, sub formă de pulbere de polistiren sulfonat de sodiu, o rășină schimbătoare de cationi preparată în faza de sodiu cu o capacitate de schimb in vitro de aproximativ 3.1 mEq (in vivo aproximativ 1 mEq) de potasiu pe gram. Conținutul de sodiu este de aproximativ 100 mg (4,1 mEq) pe gram de medicament. Poate fi administrat oral sau într-o clismă.
pulbere de Kalexat – Farmacologie Clinică
pe măsură ce rășina trece de-a lungul intestinului sau este reținută în colon după administrarea prin clismă, ionii de sodiu sunt parțial eliberați și sunt înlocuiți cu ioni de potasiu. În cea mai mare parte, această acțiune are loc în intestinul gros, care excretă ionii de potasiu într-o măsură mai mare decât intestinul subțire. Eficiența acestui proces este limitată și imprevizibil variabilă. Se apropie de obicei de ordinul a 33%, dar intervalul este atât de mare încât indicii definitivi ai echilibrului electrolitic trebuie monitorizați în mod clar.
datele metabolice nu sunt disponibile.
indicații și utilizare pentru pulberea de Kalexat
sulfonat de polistiren de sodiu, USP este indicat pentru tratamentul hiperkaliemiei.
contraindicații
sulfonat de polistiren de sodiu, USP este contraindicat în următoarele condiții: pacienți cu hipokaliemie, pacienți cu antecedente de hipersensibilitate la rășini sulfonate de polistiren, boală intestinală obstructivă, nou-născuți cu motilitate intestinală redusă (postoperator sau indusă de medicamente) și administrare orală la nou-născuți (vezi precauții).
avertismente
necroză intestinală: au fost raportate cazuri de necroză intestinală, care poate fi fatală și alte evenimente adverse gastro-intestinale grave (sângerare, colită ischemică, perforație) în asociere cu polistiren sulfonat de sodiu, utilizarea USP. Majoritatea acestor cazuri au raportat utilizarea concomitentă de sorbitol. Factorii de risc pentru evenimentele adverse gastro-intestinale au fost prezenți în multe dintre cazuri, inclusiv prematuritate, antecedente de boli intestinale sau intervenții chirurgicale, hipovolemie și insuficiență și insuficiență renală. Administrarea concomitentă de sorbitol nu este recomandată (vezi precauții, interacțiuni medicamentoase).
• se utilizează numai la pacienții cu funcție intestinală normală. Evitați utilizarea la pacienții care nu au avut o mișcare intestinală post-chirurgicală.
• evitați utilizarea la pacienții cu risc de apariție a constipației sau a afectării (inclusiv la cei cu antecedente de afectare, constipație cronică, boală inflamatorie intestinală, colită ischemică, ateroscleroză intestinală vasculară, rezecție intestinală anterioară sau obstrucție intestinală).
• întrerupeți utilizarea la pacienții care dezvoltă constipație.
terapie alternativă în hiperkaliemia severă
deoarece scăderea eficientă a potasiului seric cu polistiren sulfonat de sodiu, USP poate dura ore până la zile, tratamentul numai cu acest medicament poate fi insuficient pentru a corecta rapid hiperkaliemia severă asociată cu stări de descompunere rapidă a țesuturilor (de exemplu, arsuri și insuficiență renală) sau hiperkaliemie marcată astfel încât să constituie o urgență medicală. Prin urmare, alte măsuri definitive, inclusiv dializa, trebuie luate întotdeauna în considerare și pot fi imperative.
hipokaliemie
deficiență gravă de potasiu poate apărea din terapia cu polistiren sulfonat de sodiu, USP. Efectul trebuie controlat cu atenție prin determinări frecvente ale potasiului seric în fiecare perioadă de 24 de ore. Deoarece deficitul intracelular de potasiu nu este întotdeauna reflectat de nivelurile serice de potasiu, nivelul la care tratamentul cu polistiren sulfonat de sodiu, USP trebuie întrerupt trebuie determinat individual pentru fiecare pacient. Ajutoare importante în efectuarea acestei determinări sunt starea clinică a pacientului și electrocardiograma. Semnele clinice precoce ale hipokaliemiei severe includ un model de confuzie iritabilă și procese de gândire întârziate.
electrocardiografic, hipokaliemia severă este adesea asociată cu un interval Q-T prelungit, lărgirea, aplatizarea sau inversarea undei T și undele u proeminente. De asemenea, pot apărea aritmii cardiace, cum ar fi contracțiile premature atriale, nodale și ventriculare și tahicardiile supraventriculare și ventriculare. Efectele toxice ale digitalisului sunt probabil exagerate. Hipokaliemia marcată se poate manifesta și prin slăbiciune musculară severă, uneori extinzându-se în paralizie sinceră.
tulburări electrolitice
ca toate rășinile schimbătoare de cationi, sulfonatul de polistiren de sodiu, USP nu este total selectiv (pentru potasiu) în acțiunile sale și cantități mici de alți cationi, cum ar fi magneziu și calciu, pot fi, de asemenea, pierdute în timpul tratamentului. În consecință, pacienții care primesc polistiren sulfonat de sodiu, USP trebuie monitorizați pentru toate tulburările electrolitice aplicabile.
alcaloză sistemică
alcaloză sistemică a fost raportată după ce rășinile schimbătoare de cationi au fost administrate pe cale orală în asociere cu antiacide donatoare de cationi neabsorbabile și laxative precum hidroxidul de magneziu și carbonatul de aluminiu. Hidroxidul de magneziu nu trebuie administrat cu polistiren sulfonat de sodiu, USP. Un caz de criză grand mal a fost raportat la un pacient cu hipocalcemie cronică de insuficiență renală căruia i s-a administrat polistiren sulfonat de sodiu, USP cu hidroxid de magneziu ca laxativ. (Vezi precauții, interacțiuni medicamentoase.)
Precauții
se recomandă prudență atunci când se administrează sulfonat de polistiren de sodiu, USP la pacienții care nu pot tolera nici măcar o creștere mică a sarcinilor de sodiu (adică insuficiență cardiacă congestivă severă, hipertensiune arterială severă sau edem marcat). În astfel de cazuri poate fi indicată o restricție compensatorie a aportului de sodiu din alte surse.
în caz de constipație semnificativă clinic, tratamentul cu polistiren sulfonat de sodiu, USP trebuie întrerupt până la reluarea mișcării intestinale normale (vezi avertismente, necroză intestinală).
interacțiuni medicamentoase
antiacide
administrarea orală simultană de polistiren sulfonat de sodiu, USP cu antiacide donatoare de cationi neabsorbabile și laxative poate reduce capacitatea de schimb de potasiu a rășinii.
antiacide donatoare de cationi neabsorbabile și laxative
alcaloză sistemică a fost raportată după ce rășinile schimbătoare de cationi au fost administrate pe cale orală în asociere cu antiacide donatoare de cationi neabsorbabile și laxative precum hidroxidul de magneziu și carbonatul de aluminiu. Hidroxidul de magneziu nu trebuie administrat cu polistiren sulfonat de sodiu, USP. Un caz de criză grand mal a fost raportat la un pacient cu hipocalcemie cronică de insuficiență renală căruia i s-a administrat polistiren sulfonat de sodiu, USP cu hidroxid de magneziu ca laxativ.
obstrucție intestinală datorată concrețiilor de hidroxid de aluminiu atunci când este utilizat în combinație cu polistiren sulfonat de sodiu, USP a fost raportat.
Digitalis
efectele toxice ale digitalisului asupra inimii, în special diverse aritmii ventriculare și disociere nodală A-V, sunt susceptibile de a fi exagerate de hipokaliemie, chiar și în fața concentrațiilor serice de digoxină în „intervalul normal”. (Vezi avertismente).
Sorbitol
utilizarea concomitentă a sorbitolului cu polistiren sulfonat de sodiu, USP a fost implicată în cazurile de necroză intestinală, care poate fi fatală. De aceea, nu se recomandă administrarea concomitentă. (Vezi avertismente).
litiu
polistiren sulfonat de sodiu, USP poate reduce absorbția de litiu.
tiroxina
polistiren sulfonat de sodiu, USP poate scădea absorbția tiroxinei.
carcinogeneza, mutageneza, afectarea fertilității
nu au fost efectuate studii.
sarcina categoria C
studiile privind reproducerea la animale nu au fost efectuate cu polistiren sulfonat de sodiu, USP. De asemenea, nu se știe dacă sulfonatul de polistiren de sodiu, USP poate provoca vătămări fetale atunci când este administrat unei femei însărcinate sau poate afecta capacitatea de reproducere. Sulfonatul de polistiren de sodiu, USP, trebuie administrat unei femei însărcinate numai dacă este clar necesar.
mamele care alăptează
nu se știe dacă acest medicament este excretat în laptele uman. Deoarece multe medicamente sunt excretate în laptele uman, trebuie să aveți precauție atunci când sulfonatul de polistiren de sodiu, USP este administrat unei femei care alăptează.
utilizare pediatrică
eficacitatea Sulfonatului de polistiren de sodiu, USP la pacienții pediatri nu a fost stabilită. La nou-născuți, polistiren sulfonat de sodiu, USP nu trebuie administrat pe cale orală. Atât la copii, cât și la nou-născuți, trebuie acordată o atenție deosebită administrării rectale, deoarece dozarea excesivă sau diluția inadecvată ar putea duce la afectarea rășinii.
datorită riscului de hemoragie digestivă sau necroză intestinală, trebuie acordată o atenție deosebită sugarilor prematuri sau sugarilor cu greutate mică la naștere.
reacții Adverse
polistiren sulfonat de sodiu, USP poate provoca un anumit grad de iritație gastrică. Anorexia, greața, vărsăturile și constipația pot apărea mai ales dacă se administrează doze mari. De asemenea, pot apărea hipokaliemie, hipocalcemie, hipomagneziemie și retenție semnificativă de sodiu și manifestările clinice asociate acestora (vezi avertismente). Ocazional se dezvoltă diaree. Dozele mari la persoanele în vârstă pot provoca impactări fecale (vezi precauții). Au fost raportate cazuri Rare de necroză intestinală. A fost raportată obstrucția intestinală datorată concrețiilor de hidroxid de aluminiu, atunci când este utilizată în combinație cu polistiren sulfonat de sodiu, USP.
următoarele evenimente au fost raportate din experiența mondială după punerea pe piață:
• impactare fecală după administrarea rectală, în special la copii;
• concreții gastro-intestinale (bezoars) după administrarea orală;
• colită ischemică, ulcerații sau necroză ale tractului gastro-intestinal care ar putea duce la perforații intestinale; și,
• cazuri Rare de bronșită acută și/sau bronho-pneumonie asociate cu inhalarea particulelor de polistiren sulfonat.
supradozajul
supradozajul poate determina tulburări electrolitice, inclusiv hipokaliemie, hipocalcemie și hipomagneziemie .Tulburările biochimice rezultate din supradozaj pot da naștere la semne și simptome clinice de hipokaliemie, inclusiv: iritabilitate, confuzie, procese de gândire întârziate, slăbiciune musculară, hiporeflexie, care poate progresa spre paralizie sinceră și/sau apnee. Se poate produce tetanie. Modificările electrocardiografice pot fi în concordanță cu hipokaliemia sau hipercalcemia; pot apărea aritmii cardiace. Trebuie luate măsuri adecvate pentru corectarea electroliților serici (potasiu, calciu, magneziu), iar rășina trebuie îndepărtată din tractul alimentar prin utilizarea adecvată a laxativelor sau a clismei.
doza și administrarea de pulbere de Kalexat
suspensia acestui medicament trebuie preparată proaspăt și nu trebuie păstrată peste 24 de ore.
doza medie zilnică de rășină pentru adulți este de 15 g până la 60 g. Acest lucru este cel mai bine furnizat prin administrarea a 15 g (aproximativ 4 lingurițe de nivel) de polistiren sulfonat de sodiu, USP de una până la patru ori pe zi. Un gram de polistiren sulfonat de sodiu, USP conține 4,1 mEq de sodiu; o linguriță de nivel conține aproximativ 3,5 g de polistiren sulfonat de sodiu, USP și 15 mEq de sodiu. (O linguriță cu vârf poate conține până la 10 g până la 12 g de polistiren sulfonat de sodiu, USP.) Deoarece eficiența in vivo a rășinilor schimbătoare de sodiu-potasiu este de aproximativ 33%, aproximativ o treime din conținutul real de sodiu al rășinii este livrat organismului.
la copiii și sugarii mai mici, trebuie utilizate doze mai mici, utilizând ca ghid o rată de 1 mEq de potasiu pe gram de rășină ca bază pentru calcul.
fiecare doză trebuie administrată sub formă de suspensie într-o cantitate mică de apă sau, pentru o mai mare palatabilitate, în sirop. Cantitatea de lichid variază de obicei de la 20 mL la 100 mL, în funcție de doză, sau poate fi determinată pur și simplu permițând 3 mL până la 4 mL pe gram de rășină. Profesioniștii din domeniul sănătății trebuie să respecte precauțiile complete de aspirare atunci când administrează acest produs, cum ar fi plasarea și menținerea pacientului în poziție verticală în timp ce se administrează rășina.
rășina poate fi introdusă în stomac printr-un tub de plastic și, dacă se dorește, amestecată cu o dietă adecvată pentru un pacient cu insuficiență renală.
rășina poate fi, de asemenea, administrată, deși cu rezultate mai puțin eficiente, într-o clismă constând (pentru adulți) de 30 g până la 50 g la fiecare șase ore. Fiecare doză se administrează sub formă de emulsie caldă (la temperatura corpului) în 100 mL de vehicul apos. Emulsia trebuie agitată ușor în timpul administrării. Clisma trebuie păstrată cât mai mult timp posibil și urmată de o clismă de curățare.
după o clismă inițială de curățare, un tub de cauciuc moale, de dimensiuni mari (Franceză 28) este introdus în rect pentru o distanță de aproximativ 20 cm, cu vârful bine în colonul sigmoid și înregistrat în poziție. Rășina este apoi suspendată în cantitatea corespunzătoare de vehicul apos la temperatura corpului și introdusă prin gravitație, în timp ce particulele sunt ținute în suspensie prin agitare. Suspensia este spălată cu 50 mL sau 100 mL de lichid, după care tubul este fixat și lăsat în poziție. Dacă apare scurgerea din spate, șoldurile sunt ridicate pe perne sau se ia temporar o poziție genunchi-piept. Poate fi utilizată o suspensie ceva mai groasă, dar trebuie avut grijă să nu se formeze pastă, deoarece aceasta din urmă are o suprafață de schimb foarte redusă și va fi deosebit de ineficientă dacă este depusă în ampula rectală. Suspensia este menținută în colonul sigmoid timp de câteva ore, dacă este posibil. Apoi, colonul este irigat cu soluție care conține nonsodiu la temperatura corpului pentru a îndepărta rășina. Pot fi necesare două litri de soluție de spălare. Retururile sunt drenate constant printr-o conexiune cu tub Y. Deși utilizarea sorbitolului nu este recomandată, trebuie acordată o atenție deosebită acestei clisme de curățare dacă sorbitolul a fost utilizat
intensitatea și durata tratamentului depind de severitatea și rezistența hiperkaliemiei.
sulfonat de polistiren de sodiu, USP nu trebuie încălzit pentru a face acest lucru poate modifica proprietățile de schimb ale rășinii.
cum se furnizează pulbere de Kalexat
sulfonat de polistiren de sodiu, USP este disponibil sub formă de cremă până la maro deschis, pulbere măcinată fin în borcane de 1 kilogram (454 g),
NDC 10702-036-45.
Magazin de la 20° la 25°C (68° la 77°F), cu excursii permisă între 15° și 30°C (59° la 86°F) .
numai Rx
fabricat de:
KVK-TECH INC.
110 Terry unitate
oraș nou, PA 18940 Statele Unite ale Americii.
ID articol # 006067/04
codul producătorului: 10702 10/13
eticheta pachetului.Panou principal de afișare
454 g etichetă borcan
NDC 10702-036-45
polistiren sulfonat de sodiu, USP
rășină schimbătoare de cationi
454 g
numai Rx
doza medie pentru adulți: 15 g (aproximativ 4 lingurițe de nivel) de una până la patru ori pe zi în apă. Consultați informațiile complete de prescriere.
efectul trebuie controlat cu atenție prin determinări frecvente ale potasiului seric în fiecare interval de 24 de ore. Conținutul de sodiu aproximativ 60 mEq la 15 g.
suspensia trebuie preparată proaspăt și nu trebuie păstrată mai mult de 24 de ore. Se distribuie în recipiente etanșe, rezistente la lumină, așa cum sunt definite în compendia oficială.
Magazin de la 20° la 25°C (68° la 77°F), cu excursii permisă între 15° și 30°C (59° la 86°F) .
KVK-TECH, INC.

| KALEXATE sodium polystyrene sulfonate powder |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
etichetă-KVK-Tech, Inc. (173360061)
înregistrare-KVK-Tech, Inc. (173360061)
| înființare | |||
| nume | adresa | Id/Fei | operațiuni |
| KVK-Tech, Inc. | 173360061 | fabricare(10702-036) | |
mai multe despre Kalexat (polistiren sulfonat de sodiu)
- efecte secundare
- în timpul sarcinii sau alăptării
- informații privind dozajul
- interacțiuni medicamentoase
- prețuri & cupoane
- spaniolă
- clasa de medicamente: rășini schimbătoare de cationi
- alerte FDA(2)
resurse pentru consumatori
- informații pentru pacienți
resurse profesionale
- informații de prescriere
- pulbere orală de polistiren sulfonat de sodiu (FDA)
Alte mărci Kayexalat, Kionex
ghiduri de tratament conexe
- hiperkaliemie
Disclaimer Medical