
Auf den meisten dieser Seiten haben wir über Polymere gesprochen, deren Rückgratketten hauptsächlich aus Kohlenstoffatomen bestehen, wenn nicht sogar vollständig aus Kohlenstoffatomen. Diese nennen wir organische Polymere. Aber jetzt werden wir die Konvention hinter uns lassen und über einige Polymere sprechen, die keine Kohlenstoffatome in der Rückgratkette haben. Diese werden, als ob Sie nicht erraten könnten, anorganische Polymere genannt. Hier ist ein Menü der anorganischen Polymere auf dieser Seite, um Ihnen die Navigation zu erleichtern:
- Silicone Polysilane Polygermane und Polystannane Polyphospahazene
Silicone
Sie haben sicherlich schon anorganische Polymere gesehen, insbesondere solche, die Silikone genannt werden. Silikone sind die häufigsten anorganischen Polymere. Sie sehen so aus:
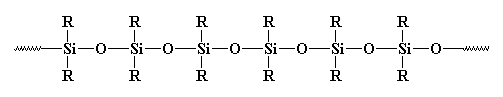
Sie sollten wirklich Polysiloxane genannt werden. Die Bindung zwischen Silizium und Sauerstoff ist sehr stark, aber sehr flexibel. So können Silicone hohe Temperaturen aushalten, ohne sich zu zersetzen, aber sie haben sehr niedrige Glasübergangstemperaturen. Sie haben wahrscheinlich Gummi oder Verstemmen aus Silikonen irgendwo gesehen.vorher.
Polysilane
Werfen wir einen Blick auf das Element Silizium. Sie können sehen, dass es direkt unter Kohlenstoff im Periodensystem ist. Wie Sie sich vielleicht erinnern, haben Elemente in derselben Spalte oder Gruppe im Periodensystem oft sehr ähnliche Eigenschaften. Wenn also Kohlenstoff lange Polymerketten bilden kann, dann sollte Silizium auch dazu in der Lage sein.
Richtig?
Richtig. Es hat lange gedauert, aber Siliziumatome wurden zu langen Polymerketten verarbeitet. In den 1920er und 30er Jahren begannen Chemiker herauszufinden, dass organische Polymere aus langen Kohlenstoffketten bestehen, aber ernsthafte Untersuchungen von Polysilanen wurden erst Ende der siebziger Jahre durchgeführt.
Früher, 1949, ungefähr zur gleichen Zeit, als der Schriftsteller Kurt Vonnegut für die Abteilung für Öffentlichkeitsarbeit bei General Electric arbeitete, arbeitete C.A. Burkhard in der Forschungs- und Entwicklungsabteilung von G.E. Er erfand ein Polysilan namens Polydimethylsilan, aber es war für nichts gut. Es sah so aus:
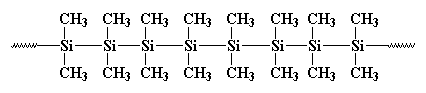
Es bildete Kristalle, die so stark waren, dass nichts sie auflösen konnte. Burkhard versuchte es zu erhitzen, aber es schmolz nicht unter 250oC, wenn es sich zersetzte, ohne zu schmelzen. Das machte Polydimethylsilan ziemlich nutzlos. Er machte es durch Reaktion von Natriummetall mit Dichlordimethylsilan wie folgt:
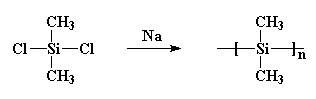
Dies ist wichtig, weil in den siebziger Jahren einige Wissenschaftler die Vorstellung hatten, dass sie kleine Ringe aus Siliziumatomen herstellen würden. Also tat er unwissentlich etwas Ähnliches wie Burkhard. Sie setzten Natriummetall mit Dichlordimethylsilan um, fügten dem Gebräu aber auch etwas Dichlormethylphenylsilan hinzu. Und rate mal, was passiert ist! Ich gebe Ihnen einen Hinweis: Sie haben nicht die Ringe bekommen, die sie wollten. Was sie bekamen, war ein Copolymer wie dieses:
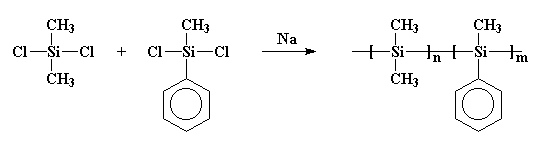
Vielleicht ist dieses Polymer deutlicher so gezeichnet:
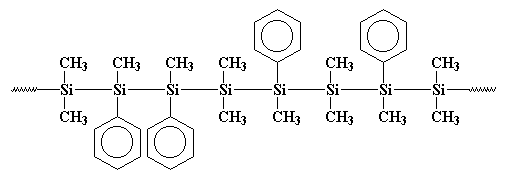
Sie sehen, diese Phenylgruppen stören, wenn das Polymer zu kristallisieren versucht, also ist es nicht so kristallin wie Polydimethylsilan. Dies bedeutet, dass es löslich ist und verarbeitet, gespielt und untersucht werden kann.
Also, wofür sind diese gut? Polysilane sind interessant, weil sie Elektrizität leiten können. Nicht so gut wie Kupfer, wohlgemerkt, aber viel besser als man es von einem Polymer erwarten würde, und es lohnt sich, es zu untersuchen. Sie sind auch sehr hitzebeständig, fast bis zu 300 oC, aber wenn Sie sie viel höher erhitzen, können Sie daraus Siliziumkarbid herstellen, das ein nützliches Schleifmaterial ist.
Polygermane und Polystannane
Okay, wenn Silizium lange Polymerketten bilden kann, was ist mit den anderen Elementen in Gruppe IV? Kann man Polymere aus Germanium herstellen? Du solltest besser glauben, dass du es kannst! Sie können nicht nur Polymerketten aus Germanium herstellen, sondern sogar eine Polymerkette aus Zinnatomen. Diese Polymere werden Polygermane bzw. Polystannane genannt.

Polystannane sind einzigartig und raffiniert und wunderbar und fabelhaft, weil sie die einzigen bekannten Polymere sind, deren Rückgrat vollständig aus Metallatomen besteht. Wie Polysilane werden auch Polygermane und Polystannane für die Verwendung als elektrische Leiter untersucht.
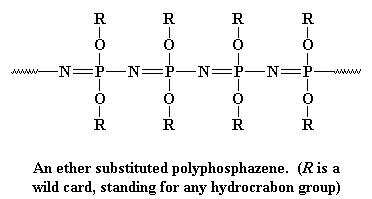
Dieses Rückgrat ist sehr flexibel, wie die Polysiloxan-Rückgratkette, so dass Polyphosphazene gute Elastomere bilden. Sie sind auch sehr gute elektrische Isolatoren. Polyphosphazene werden in zwei Schritten hergestellt:
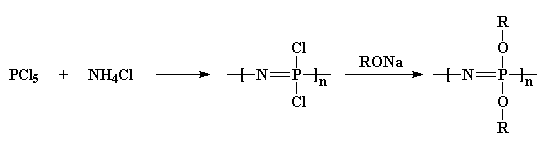
Zuerst nehmen wir Phosphorpentachlorid und reagieren es mit Ammoniumchlorid, um ein chloriertes Polymer zu erhalten. Dann behandeln wir es mit einem Alkohol-Natriumsalz, und das gibt uns ein Ether-substituiertes Polyphosphazen.
Nun, das ist genug von diesem faszinierenden Thema für jetzt. Zwar gibt es neue und aufregende anorganische Polymere, die hergestellt wurden (die Forschung schreitet natürlich voran), aber wir können auf diesen Seiten nicht alles abdecken. Und vergessen Sie nicht, es gibt interessante Kombinationen von Heteroatomen (Nicht-Kohlenstoffatome) mit Kohlenstoffatomen in einer Vielzahl von Polymer-Backbones und pendenten Gruppen. Diese könnten als „semi-anorganisch“ bezeichnet werden, obwohl dies für einige zu künstlich sein könnte.
 |
Zurück zum Level Three Verzeichnis |
 |
Zurück zuMacrogalleria Verzeichnis |