
op de meeste van deze pagina ‘ s hebben we het gehad over polymeren waarvan de backbone ketens voornamelijk bestaan uit koolstofatomen, zo niet volledig uit koolstofatomen. Deze noemen we organische polymeren. Maar nu laten we de conventie achter ons en praten we over polymeren die geen koolstofatomen in de backbone keten hebben. Deze heten, alsof je het niet kon raden, anorganische polymeren. Hier is een menu als de anorganische polymeren op deze pagina om u te helpen navigeren:
- Siliconen Polysilanen Polygermanen en polystannanen Polyfospahazenen
Siliconen
u hebt zeker al eerder anorganische polymeren gezien, vooral die welke siliconen worden genoemd. Siliconen zijn de meest voorkomende anorganische polymeren. Ze zien er zo uit.:
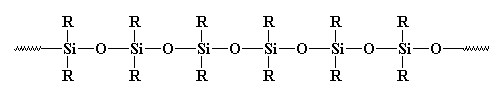
ze zouden echt polysiloxanen moeten heten. De band tussen silicium en zuurstof is zeer sterk, maar zeer flexibel. Siliconen kunnen dus tegen hoge temperaturen zonder te ontbinden, maar ze hebben een zeer lage glastemperatuur. Je hebt waarschijnlijk eerder rubber of breeuwen van siliconen gezien.
Polysilanen
laten we even naar het element silicium kijken. Je kunt zien dat het precies onder koolstof ligt in de periodieke grafiek. Zoals u zich wellicht herinnert, hebben elementen in dezelfde kolom of groep op de periodieke grafiek vaak zeer vergelijkbare eigenschappen. Dus, als koolstof lange polymeerketens kan vormen, dan moet silicium dat ook kunnen.
juist?
rechts. Het duurde lang om het te laten gebeuren, maar silicium atomen zijn gemaakt in lange polymeerketens. Het was in de jaren ’20 en’ 30 dat chemici erachter begonnen te komen dat organische polymeren gemaakt waren van lange koolstofketens, maar serieus onderzoek naar polysilanen werd pas eind jaren ‘ 70 uitgevoerd. Eerder, in 1949, rond dezelfde tijd dat schrijver Kurt Vonnegut werkte voor de public relations-afdeling bij General Electric, werkte C. A. Burkhard in G. E. ‘ S onderzoeks-en ontwikkelingsafdeling. Hij vond een polysilaan uit genaamd polydimethylsilaan, maar het was nergens goed voor. Het zag er zo uit:
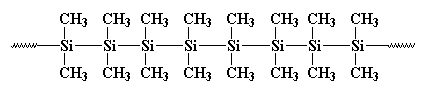
het vormde kristallen die zo sterk waren dat niets ze kon oplossen. Burkhard probeerde het te verhitten, maar het zou niet smelten onder 250oC, wanneer het ontbond, zonder te smelten. Dat maakte polydimethylsilaan vrijwel nutteloos. Hij maakte het door natriummetaal te reageren met dichloordimethylsilaan zoals dit:
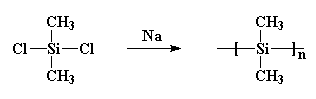
dit is belangrijk, want in de jaren zeventig kregen sommige wetenschappers het idee dat ze kleine ringen van siliciumatomen gingen maken. Zo onbewust deed iets gelijkaardig aan wat Burkhard had gedaan. Ze reageerden natriummetaal met dichloordimethylsilaan, maar ze voegden ook wat dichloormethylfenylsilaan toe aan het brouwsel. En raad eens wat er gebeurde! Ik zal je een hint geven: ze hebben de ringen niet gekregen die ze wilden. Wat ze kregen was een copolymeer, zoals dit.:
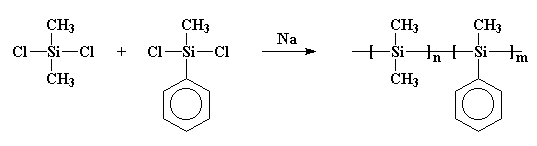
misschien is dat polymeer duidelijker getekend.:
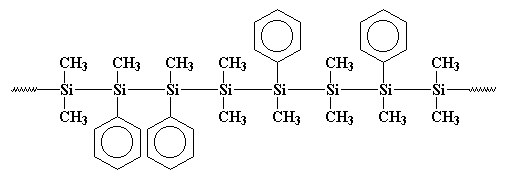
die fenylgroepen staan in de weg als het polymeer probeert te kristalliseren, dus het is niet zo kristallijn als polydimethylsilaan. Dit betekent dat het oplosbaar is en kan worden verwerkt, gespeeld en bestudeerd.
dus waar zijn deze goed voor? Polysilanen zijn interessant omdat ze elektriciteit kunnen geleiden. Niet zo goed als koper, maar veel beter dan je zou verwachten voor een polymeer, en het onderzoeken waard. Ze zijn ook zeer hittebestendig, bijna tot 300 oC, maar als je ze veel hoger verhit kun je er siliciumcarbide van maken, wat een nuttig schuurmiddel is.
Polygermanen en Polystannanen
Oké, dus als silicium lange polymeerketens kan maken, hoe zit het dan met de andere elementen in groep IV? Kun je polymeren maken van germanium? Je kunt het maar beter geloven! Je kunt niet alleen polymeerketens maken van germanium, maar je kunt zelfs een polymeerketting maken van tinatomen. Deze polymeren worden polygermanen en polystannanen genoemd, respectievelijk.

Polystannanen zijn uniek en handig en prachtig en fabelachtig omdat ze de enige bekende polymeren zijn met backbones volledig gemaakt van metaalatomen. Net als polysilanen worden polygermanen en polystannanen bestudeerd voor gebruik als elektrische geleiders.
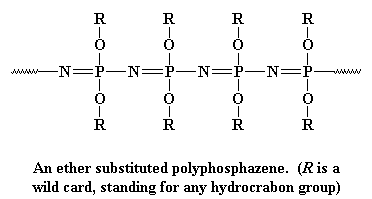
deze ruggengraat is erg flexibel, net als de polysiloxaan backbone keten, dus polyfosfazenes maken goede elastomeren. Het zijn ook zeer goede elektrische isolatoren. Polyfosfazenes worden in twee stappen gemaakt:
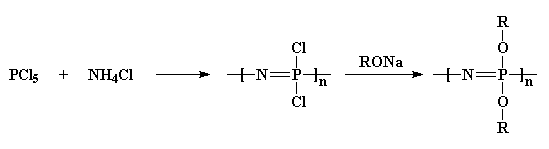
eerst nemen we fosforpentachloride en reageren het met ammoniumchloride om een gechloreerd polymeer te krijgen. Dan behandelen we het met een alcohol natriumzout, en dat geeft ons een ether-gesubstitueerd polyfosfazeen.
nou, dat is genoeg van dit fascinerende onderwerp voor nu. Hoewel er misschien nieuwe en opwindende anorganische polymeren zijn gemaakt (research marches op, natuurlijk), kunnen we niet alles op deze pagina ‘ s behandelen. En vergeet niet, er zijn interessante combinaties van heteroatomen (niet-koolstofatomen) met koolstofatomen in een verscheidenheid van polymeer backbones en pendent groepen. Deze zouden “semi-anorganisch” kunnen worden genoemd, hoewel dat Voor sommigen misschien te kunstmatig is.
 |
terug naar Level Three Directory |
 |
Return toMacrogalleria Directory |