| Autor | |
|---|---|
| Lindsay A. Weiner, MD | University of Maryland Medical Center, Baltimore, Maryland |
| George Willis, MD | University of Maryland School Of Medicine, Department of Emergency Medicine, Baltimore, Maryland |
| Zachary D. W. Dezman, MD, MS, MS | University of Maryland School Of Medicine, Department of Emergency Medicine, Baltimore, Maryland |
| Laura J. Bontempo, MD, MEd | University of Maryland School Of Medicine, Department of Emergency Medicine, Baltimore, Maryland |
prezentacja przypadku
omówienie przypadku
wyniki przypadku
dyskusja rezydenta
ostateczna diagnoza
kluczowe punkty nauczania
prezentacja przypadku
52-letnia kobieta przyszła do oddziału ratunkowego (ED) na hemodializę (HD) z powodu schyłkowej choroby nerek (ESRD). Przez kilka tygodni przebywała w szpitalu zewnętrznym, leczona daptomycyną z powodu zapalenia płuc i bakteriemii. Po usunięciu cewnika dostępowego do dializy odeszła wbrew zaleceniom medycznym (AMA). Zaprezentowała się naszej ED, ponieważ potrzebowała dostępu naczyniowego HD i ponownego rozpoczęcia leczenia dializami. Jej historia medyczna obejmuje przewlekłą chorobę nerek wtórną do nadciśnieniowej miażdżycy nerek, niedokrwistość, nadciśnienie tętnicze, zakrzepy żył głębokich (DVT), toczeń rumieniowaty układowy i zaburzenia napadowe o nieznanej etiologii.
pacjent, świadek Jehowy, odmówił transfuzji krwi; dlatego jej niedokrwistość leczono dożylnym (IV) podaniem żelaza, epoetyny alfa i kwasu foliowego. Inne leki obejmowały nifedypinę, klonidynę, metoprolol, sewelamer i prednizon. Była uczulona na amoksycylinę, azytromycynę, hydralazynę, labetolol, linezolid, morfinę i wankomycynę. Zgłosiła wcześniejsze zażywanie heroiny dożylnie wiele lat wcześniej i wcześniejsze palenie papierosów. Odmówiła używania alkoholu, narkotyków i tytoniu.
3° Celsjusza, tętno 87 uderzeń na minutę (bpm), ciśnienie krwi 110/65 milimetrów rtęci (mmHg), częstość oddechów 17 oddechów na minutę i pulsoksymetria 99% podczas oddychania powietrzem w pomieszczeniu. Ważyła 80 kilogramów i miała 170 cm wzrostu. Jej głowa była normocephaliczna i atraumatyczna z wilgotnymi błonami śluzowymi. Źrenice były anikteryczne, równe, okrągłe i reagowały na światło i zakwaterowanie. Szyja była elastyczna i bez limfadenopatii lub tkliwości. Jej płuca miały szorstki oddech z łagodnymi trzaskami bibasilar, ale bez świszczącego oddechu i rhonchi. Nie było cofnięć ani wzmożonej pracy oddechowej. Jej serce było regularne tempo i rytm bez szmerów, pocieranie, lub galopów. Jej brzuch był miękki z normalnymi odgłosami jelit i bez rozdęcia, czułości, odbicia lub ochrony. Nie było kosztownej czułości kąta. Kończyny dolne miały 1 + obrzęk wżerowy, 2 + impulsy dorsalis pedis i nie miały czułości ani deformacji. Pacjent miał prawidłową siłę i napięcie mięśniowe na wszystkich kończynach z nienaruszonym czuciem. Stare przetoki były obecne w lewej i prawej kończynie górnej bez wyczuwalnych emocji. Była czujna i zorientowana na osobę, miejsce i czas.
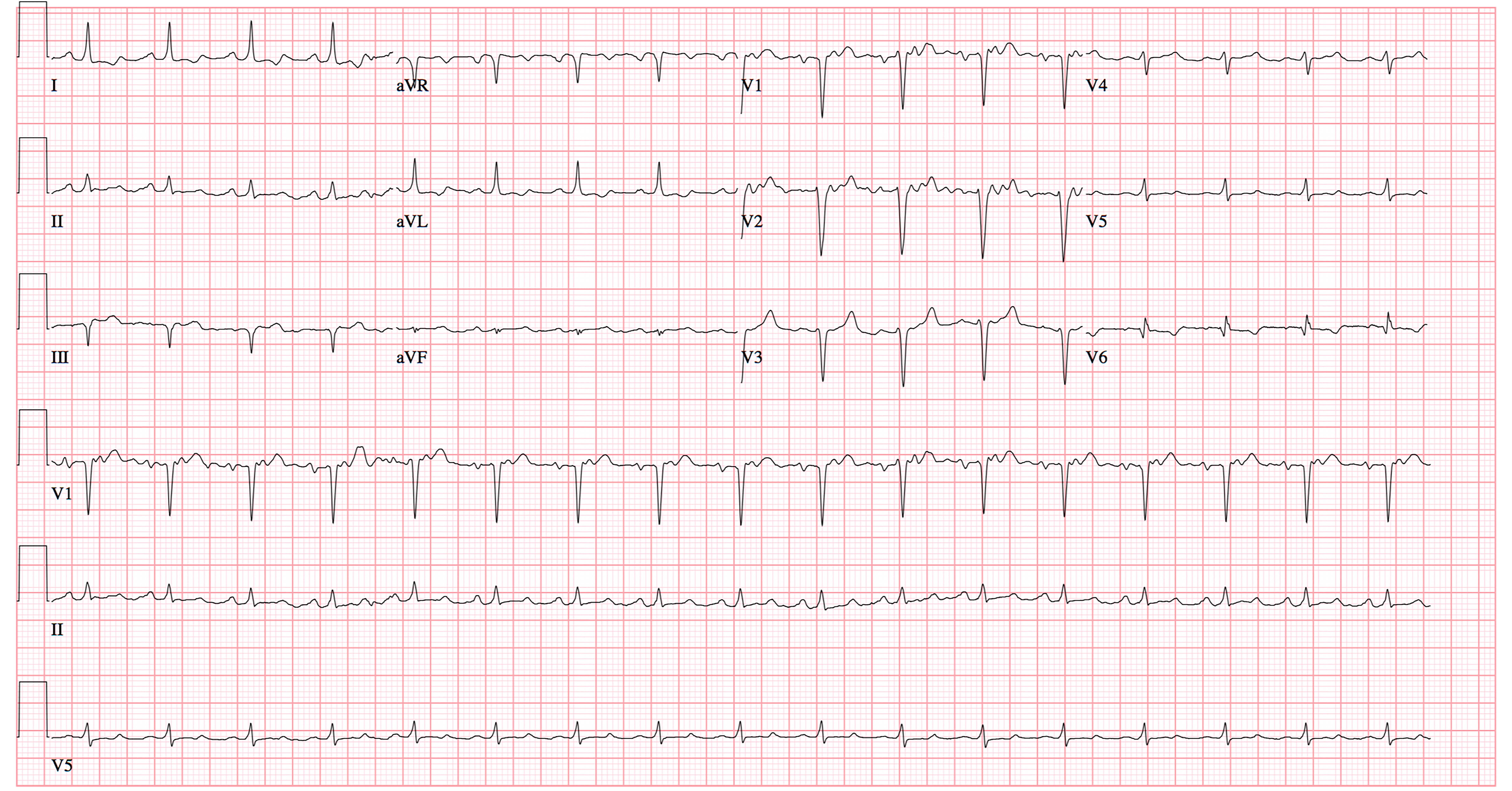
początkowe wartości laboratoryjne pacjenta przedstawiono w tabeli 1. Były one istotne dla niewielkiej leukocytozy, niedokrwistości do 5,3 g / dL, małopłytkowości, hiperkaliemii i podwyższonego stężenia kreatyniny 11,9 mg / dL. Jej początkowy elektrokardiogram (EKG) wykazał tachykardię zatokową z inwersją fali T w przewodach I i V6 (Zdjęcie 1). Wynik nie zmienił się po wcześniejszym badaniu EKG. Pacjent został przyjęty do zespołu lekarskiego i rozpoczął leczenie daptomycyną. W oczekiwaniu na umieszczenie łóżka, pacjent z oddziału intensywnej opieki medycznej (OIOM) w celu zainicjowania HD wprowadził nienałożony lewy cewnik do dializy kości udowej. Umieszczenie zostało potwierdzone łatwą wadą krwi ze wszystkich portów. Podczas procesu zgody na umieszczenie cewnika udokumentowano, że pacjentka stwierdziła, że ” woli umrzeć niż otrzymać transfuzję krwi.”Po umieszczeniu cewnika podjęto próbę rozpoczęcia HD, ale dostała hipotensyjnego ciśnienia i niemal natychmiast skarżyła się na osłabienie. Jej objawami życiowymi podczas pierwszej próby HD było ciśnienie krwi 85/56 mmHg z tętnem 105 uderzeń na minutę.
| wartości | |
|---|---|
| morfologia krwi | |
| liczba białych krwinek | 12,4 K / mcl |
| hemoglobina | 5,3 g / dL |
| Hematokryt | 15.8% |
| Platelets | 133 K/mcl |
| Basic metabolic panel | |
| Sodium | 135 mmol/L |
| Potassium | 5.8 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 27 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 189 mg/dL |
| Calcium | 7.2 mg / dL |
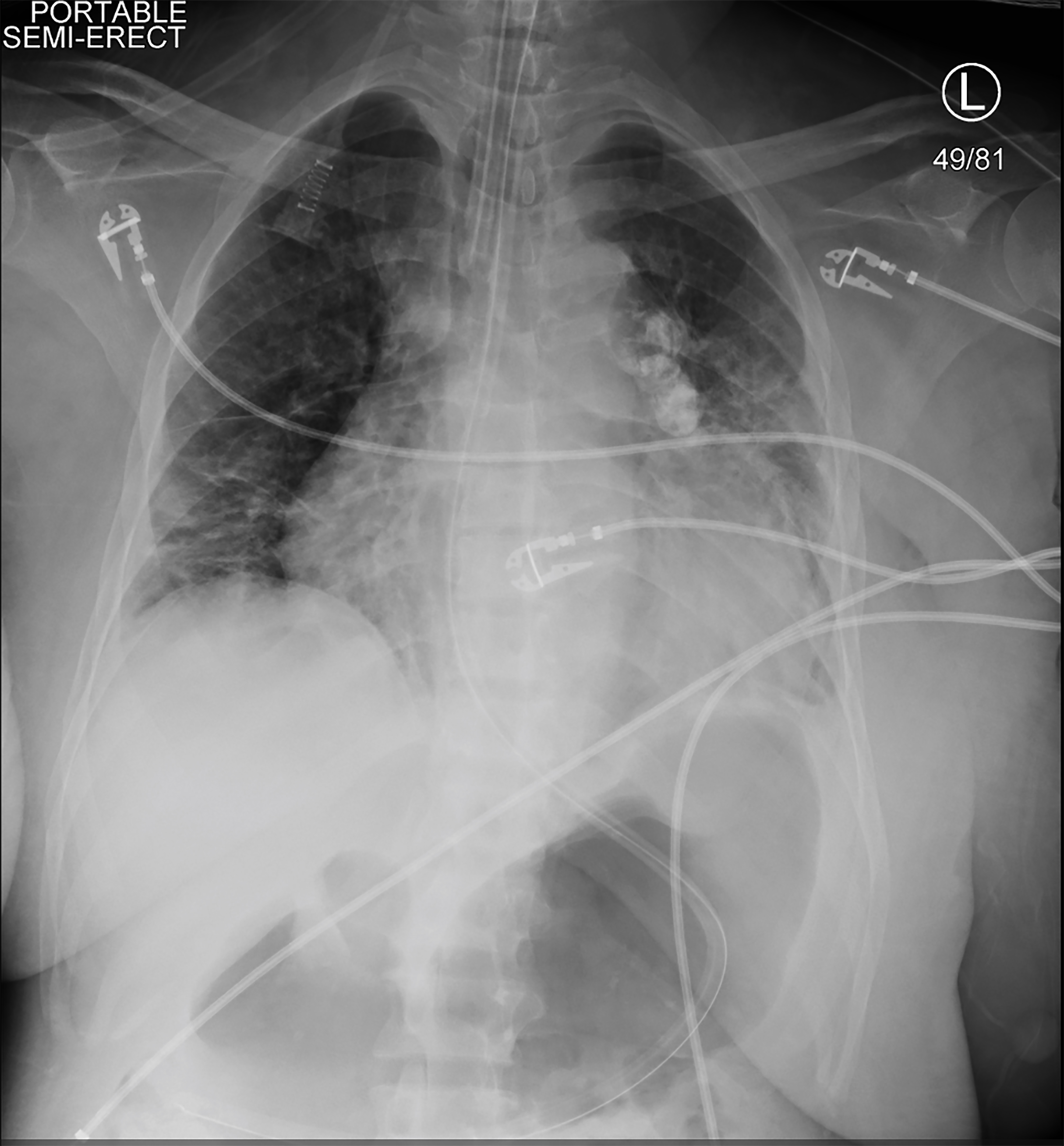
ponieważ w HD u pacjenta występowały objawy i hipotensja, rozpoczęto ciągłą terapię nerkozastępczą (ang. continuous renal replacement therapy, CRRT). Wkrótce potem dostała hipotensji, nie reagowała i miała toniczny napad kloniczny. Objawy życiowe w tym czasie to tętno 113 uderzeń na minutę, ciśnienie krwi 75/48 mmHg, częstość oddechów 20 oddechów na minutę i nasycenie tlenem 78% w powietrzu w pomieszczeniu. Krótkie, powtarzane badanie lekarskie wykazało, że pacjentka nie reaguje na bolesne bodźce, a jej źrenice były równe i reaktywne. Podano jej 4 mg lorazepamu i intubowano w celu ochrony dróg oddechowych. Umieszczono żyłkę tętniczą prawej tętnicy udowej i żyłkę środkową prawej tętnicy udowej potrójnego światła. Zdjęcie RTG klatki piersiowej potwierdziło umieszczenie rurki intubacyjnej (Zdjęcie 2). CRRT został wstrzymany, ale pacjent pozostał w szoku pomimo wlewów krystaloidów w bolusie, więc rozpoczęto podawanie leków wazopresorowych. Otrzymywała zwiększające się dawki wazopresorów, gdy powtarzające się wartości laboratoryjne wskazywały na hemoglobinę 1,6 g / dL(Tabela 2).
| Values (prior value) | |
|---|---|
| Complete blood cell count | |
| White blood cell count | 13.4 K/mcl (12.4 K/mcl) |
| Hemoglobin | 1.6 g/dL (5.3 g/dL) |
| Hematocrit | 5.7% (15.8%) |
| Platelets | 167 K/mcl (133K/mcl) |
| Complete metabolic panel | |
| Sodium | 131 mmol/L |
| Potassium | 6.7 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 14 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 169 mg/dL |
| Alanine aminotransferase | 23 u/L |
| Aspartate aminotransferase | 31 u/L |
| Alkaline phosphatase | 145 u/L |
| Total bilirubin | 0.4 mg / dL |
| białko całkowite | 5,8 g / dL |
| albumina | 3, 2 g/dL |
| Mleczan | 15 J. / L |
| Gazometria krwi tętniczej | |
| pH | 7.23 |
| PCO2 | 28 mmHg |
| PO2 | 214 mmHg |
wkrótce potem doszło do zatrzymania krążenia z rytmem bez pulsacyjnej aktywności elektrycznej (PEA). Powrót krążenia spontanicznego uzyskano po sześciu minutach resuscytacji krążeniowo-oddechowej. Podczas resuscytacji odnotowano zwiększone rozdęcie brzucha, dlatego wprowadzono cewnik moczowy z czujnikiem ciśnienia. Maksymalne Ciśnienie w drogach oddechowych i pęcherzu było mierzone odpowiednio przy ponad 60 cmH2O i 50 mmHg. Następnie konsultowano operację. Protokół transfuzji został zainicjowany po tym, jak jej najbliżsi krewni zgodzili się na transfuzję produktów krwiopochodnych. Przeprowadzono skoncentrowaną ocenę z USG dla urazu (FAST), pokazując wolny płyn w torebce Morrisona. W miarę kontynuowania resuscytacji uzyskano dodatkowe badanie i postawiono diagnozę.
CASE DISCUSSION
ten przypadek przedstawiał unikalną i Okrężną sekwencję zdarzeń, która bardzo szybko spirala w niefortunnym kierunku. W przypadku pacjentów, którzy mają niejasne lub minimalne dolegliwości, obowiązkiem dostawców jest poszukiwanie wskazówek, które pomogą w postawieniu diagnozy. Dlatego zacząłem od poszukiwania wskazówek w tym przypadku.
pacjentowi przedstawiono główną skargę na konieczność dializy. Niedawno została przyjęta do innego ośrodka na zapalenie płuc i bakteriemię i usunięto jej cewnik HD z powodu podejrzenia sepsy żylnej. Wypisała się z tej placówki po otrzymaniu daptomycyny. Nie wiadomo, jak długo była bez HD ani czy skończyła cykl antybiotyków przed wyjazdem. Jest jednak zasadniczo bezobjawowa.
jej przeszłość medyczna jest znana z napadów, a także DVT i niedokrwistości. Nie ma wzmianki o żadnych leków przeciwzakrzepowych lub przeciwpadaczkowych, co wskazuje, że albo nie pamiętała nazw swoich leków, albo nie brała żadnych. Warto zauważyć, że jest Świadkiem Jehowy i dlatego otrzymała alternatywne terapie anemii, w tym żelazo, kwas foliowy i epogen.
jej badanie wykazało, że ma gorączkę, ale z innymi stabilnymi objawami życiowymi. Spodziewałbym się tego, biorąc pod uwagę, że opuściła drugą placówkę i prawdopodobnie nie ukończyła kursu antybiotyków na zapalenie płuc i bakteriemię. Inne możliwości to zakażenie oporne na antybiotyk lub nowo nabyte zakażenie szpitalne z poprzedniego pobytu w szpitalu. Ma szorstkie dźwięki oddechu i trzaski bibasilar na badaniu płuc, co potwierdza jej historię zapalenia płuc. Zapalenie płuc jest najprawdopodobniej źródłem jej gorączki, a także bakteriemii, która może nie wykazywać objawów.
jej badania laboratoryjne wykazały pewne istotne ustalenia. Była zarówno anemiczna, jak i hiperkalemiczna. Miała także hipokalcemię i hiperfosfatemię. Miała też łagodną mocznicę. U pacjentów ze schyłkową niewydolnością nerek spodziewano się większości tych wyników. Niedokrwistość może być wynikiem choroby nerek. Inne możliwości diagnostyki różnicowej niedokrwistości obejmują krwotok, niedobór żelaza i niedobór kwasu foliowego. Ona nie skarży się na utratę krwi, ani nie mamy wskaźników czerwonych krwinek, takich jak średnia objętość ciała, aby móc postawić te alternatywne diagnozy w tym momencie. Jej hiperkaliemia wynika najprawdopodobniej z braku HD. Jej hiperfosfatemia jest najprawdopodobniej spowodowana brakiem HD; jednak daptomycyna może również powodować hiperfosfatemię.
w oczekiwaniu na umieszczenie łóżka, rozpoczęła się HD, podczas której zaczęła narzekać na uczucie osłabienia i zauważono, że ma hipotensję i tachykardię. Następnie rozpoczyna się CRRT i pozostaje hipotensyjna, staje się niedotlenieniem, nie reaguje i ma napad toniczno-kloniczny wymagający intubacji i inicjacji wazopresora. Badanie pokazuje równe i reaktywne źrenice u pacjenta nie reagującego na bodźce bolesne. Badania laboratoryjne ujawniają głęboko pogarszającą się anemię, pogorszenie hiperkaliemii i interwałowy rozwój kwasicy mleczanowej. Następnie dostaje się do aresztu grochu i po udanym powrocie spontanicznego krążenia przechodzi transfuzję krwi. Mimo intubacji nadal ma hipotensję i niedotlenienie. Ma również rozdęty brzuch i szczytowe ciśnienie w drogach oddechowych większe niż 60 cmH2O. szybkie badanie ujawnia wolny płyn w torebce Morrisona.
tak głęboka zmiana statusu po interwencji terapeutycznej wymaga poważnego przemyślenia. Zacznijmy od niedociśnienia i tachykardii podczas HD, a następnie CRRT. Niedociśnienie podczas HD jest z pewnością możliwe przy wyższych prędkościach przepływu. Jednak CRRT ma znacznie wolniejsze prędkości przepływu i niedociśnienie jest rzadsze, gdy stosuje się CRRT. Dlaczego więc ta osoba w szoku wymaga wazopresorów po rozpoczęciu HD?
kiedy zbliżam się do pacjentów ze wstrząsem, przychodzi mi do głowy wstrząs mnemoniczny (septyczny/rdzeniowy; hipowolemiczny; obturacyjny; kardiogenny; anafilaktyczny – K jak w mleku). Posocznica jest z pewnością możliwa, biorąc pod uwagę jej historię bakteriemii. Jest jednak mniej prawdopodobne, że jest przyczyną tak głębokiej dekompensacji, zwłaszcza z ostrym początkiem w inicjowaniu HD. Inną możliwością jest wstrząs hipowolemiczny lub krwotoczny. Ma czynniki ryzyka dla obu, ponieważ może być na antykoagulacji z jej historii ZŻG, jak również prawdopodobnie z mocznicowych płytek nieprawidłowego działania. Będzie to wymagało dalszego zbadania. Inną możliwością jest wstrząs obturacyjny, jak w zatorowości płucnej lub tamponadzie. Z pewnością ma na to czynniki ryzyka z historią zakrzepicy żył głębokich i nieznanym statusem przeciwzakrzepowym. Jest również niedotleniona, co nie jest wyjaśnione przez zapalenie płuc, ponieważ jej pierwotne nasycenia były powyżej 95%. Mogła również rozwinąć tamponadę z mocznicowego zapalenia osierdzia, chociaż jest to mniej prawdopodobne, biorąc pod uwagę, że jej azot mocznikowy (BUN) we krwi nie jest znacząco podwyższony i nie miała żadnych skarg na objawy zapalenia osierdzia. Inną możliwą przyczyną zapaści hemodynamicznej prowadzącej do wstrząsu obturacyjnego jest zator powietrza z nowego cewnika HD i późniejsze rozpoczęcie HD przez niego. Ponieważ jest to możliwe, musimy to nieco bardziej drażnić.
wstrząs kardiogenny jest mniej prawdopodobny, ponieważ jest mało prawdopodobne, aby rozwinął się bezbolesny zawał mięśnia sercowego tak poważny, że przeszła wstrząs kardiogenny. Problemy anafilaktyczne i endokrynologiczne są innymi możliwymi przyczynami wstrząsu. Jednak nie podawano żadnych leków ani nie wspomniano o wysypce lub kompromisie dróg oddechowych, aby zasugerować anafilaksję jako przyczynę. Należy rozważyć wstrząs endokrynologiczny, ponieważ jest na prednizonie, co może być przyczyną niewydolności nadnerczy. Hiperkaliemia i hiponatremia, które można oczekiwać z niewydolnością nadnerczy są obecne; jednak, nie ma wzmianki o niezgodności lub wymioty sterydów, dzięki czemu możliwość ta jest mniej prawdopodobne.
napady drgawkowe podczas HD to kolejna istota obecna w tym przypadku. Miała napady padaczkowe, a na liście leków nie ma leków przeciwpadaczkowych. Więc jej atak może być z pewnością spowodowany niezgodnością. Encefalopatia mocznicowa może występować jako napady w dowolnym momencie; jednak bułka jest tylko nieznacznie podwyższona, co jest mało prawdopodobne. Zespół nierównowagi dializy jest kolejną przyczyną napadów padaczkowych w HD. Jednak zwykle występuje podczas pierwszej sesji HD i wiąże się z szybkim spadkiem bułki. Ten pacjent jest na HD od jakiegoś czasu, a bułka nie jest wyraźnie podwyższona, co czyni tę diagnozę mało prawdopodobną. Wreszcie, zmniejszona perfuzja do mózgu spowodowana niedociśnieniem podczas HD może wywołać napady padaczkowe. Podczas HD pacjent dostał hipotensji, co może się zdarzyć z powodu większych przepływów. Następnie została umieszczona na CRRT, który wykorzystuje wolniejsze tempo przepływu i ma znacznie mniejszą częstość występowania niedociśnienia; jednak stała się bardziej hipotensyjna. Sugeruje to, że najprawdopodobniej istnieje jakaś inna przyczyna niedociśnienia, a nie po prostu HD.
na szybkim egzaminie też ma wolny płyn i teraz ma rozdęty brzuch. W połączeniu z pogłębiającą się anemią, muszę założyć, że krwawi do brzucha. Nie ma nic innego niż krwotok i hemoliza, które mogłyby wyjaśnić tak głęboki spadek hemoglobiny, i nie ma dowodów na podejrzane hemolizy w jej historii, badania fizykalne, lub badań pomocniczych.
u pacjenta występuje również podwyższone ciśnienie w respiratorze. Istnieje kilka powodów, dla których ciśnienie w drogach oddechowych może być podwyższone; ale w ustawieniu wzdętego brzucha i niedociśnienia, zespół przedziału brzusznego (ACS) jest na czele moich diagnoz różnicowych. Dlatego muszę założyć, że jest to stosunkowo szybkie krwawienie, ponieważ znacznie spadła jej hemoglobina, weszła w Zatrzymanie grochu, poprawiła się po transfuzjach krwi i wymaga wielu wazopresorów, aby utrzymać ciśnienie krwi. Ale dlaczego krwawi w brzuchu? Nie doświadczyła żadnego urazu brzucha, chyba że miało to miejsce podczas napadu w szpitalu; jednak gdyby tak było, założyłbym, że ta historia zostałaby podana. Z pewnością mogła doświadczyć jakiejś katastrofy aorty, takiej jak pęknięty tętniak aorty brzusznej, ale byłoby to bardzo dziwne, gdyby miało to miejsce podczas HD.
teraz musiałem zrobić krok w tył i przejrzeć wskazówki diagnostyczne jako całość i poskładać te puzzle. Biorąc pod uwagę całą tę cierpliwą prezentację, w prawie każdym aspekcie jej sekwencji zdarzeń pojawia się jeden wspólny temat. Krwotok. Anemia? Krwotok. Anemia się pogarsza? Zdecydowanie krwotok. Niedociśnienie? Krwotok. Atak? Hypoperfusion pochodzi z niedociśnienia pochodzącego z krwotoku. Niedotlenienie? Głęboka anemia, która pochodzi z krwotoku. ACS? Krwotok. Kwasica mleczanowa? Niedociśnienie i niedokrwistość z krwotoku.
teraz musimy tylko dowiedzieć się, skąd pochodzi ten krwotok. Kiedy pacjentka po raz pierwszy się zaprezentowała, wydawała się niezwykle stabilna. Nie miała żadnych skarg, a jej parametry życiowe, poza gorączką, były w normie. Wszczepiono jej cewnik HD bez żadnych komplikacji. Zaczyna HD, ciśnienie spada, tętno wzrasta i prawie natychmiast pojawiają się objawy. Mogę łatwo obwiniać HD jako przyczynę; jednak jej dostawcy inicjują CRRT, a jej niedociśnienie pogarsza się, przez co HD jest mniej prawdopodobne. Dlatego coś się wydarzyło przed rozpoczęciem HD, ponieważ była stabilna aż do początku HD. Jedyną rzeczą, która wydarzyła się przed rozpoczęciem HD, było umieszczenie cewnika HD. Nie ma wzmianki o żadnych powikłań lub znacznej utraty krwi podczas umieszczania. Jest to jednak jedyne Zdarzenie pomiędzy stabilnością pacjenta a niestabilnością.
gdyby nie było wzmianki o oczywistej komplikacji, co by się stało? Pamiętaj, że domniemane źródło krwawienia znajduje się w jamie brzusznej. Cewnik HD umieszczono w pachwinie, która znajduje się niedaleko jamy brzusznej i przestrzeni zaotrzewnowej. Jeśli dostawca wprowadzający żyłkę przebił się przez drugą stronę ściany naczynia, mógł łatwo umieścić cewnik HD tak, aby jego końcówka znajdowała się w zaotrzewnowej. W takim przypadku pacjent wynaczyniałby krew do przestrzeni zaotrzewnowej, powodując niedociśnienie, zmniejszoną perfuzję, kwasicę mleczanową i głęboką niedokrwistość. Gdy przestrzeń zaotrzewnowa wypełniona, nie byłoby zwiększone ciśnienie w jamie brzusznej prowadzące ostatecznie ACS. Przegląd literatury ujawnia opis przypadku tego typu komplikacji.1
dlatego badanie diagnostyczne, które wykonam, to angiogram tomografii komputerowej (CT) brzucha i miednicy. Pokazałoby to, gdzie został umieszczony cewnik HD i zbadałoby zaotrzewnową pod kątem oznak aktywnego krwawienia.
wynik przypadku
badaniem diagnostycznym był angiogram TOMOGRAFICZNY jamy brzusznej i miednicy. Lewy cewnik HD kości udowej przebił lewą wspólną żyłę biodrową pacjenta i utworzył prawostronny krwiak zaotrzewnowy. Zespół chirurgiczny ocenił pacjentkę i wykonał laparotomię przyłóżkową w celu leczenia ostrego ACS. Ujawniło to duży, prawostronny krwiak zaotrzewnowy i dużą ilość wodobrzusza. Hemodynamika pacjentki ustabilizowała się po tym zabiegu i była w stanie usunąć wszystkie wazopresory. Następnie została przetransportowana bezpośrednio na salę operacyjną z zespołem chirurgii naczyniowej w celu natychmiastowej naprawy lewej wspólnej żyły biodrowej.
podczas naprawy nadal otrzymywała wiele transfuzji krwi. Następnie została przeniesiona na OIOM chirurgiczny z otwartym brzuchem, który został następnie naprawiony. Pacjentka obudziła się całkowicie nienaruszona neurologicznie i została wypisana do domu pięć tygodni po urazie.
dyskusja rezydenta
ACS jest punktem końcowym spektrum, które zaczyna się od nadciśnienia w jamie brzusznej (IAH) i kończy się, gdy ciśnienie w jamie brzusznej przekracza 20 mmHg I towarzyszy dysfunkcji narządu końcowego.2 prawidłowe ciśnienie w jamie brzusznej, nawet u pacjentów w stanie krytycznym, powinno wynosić <12 mmHg. IAH, które mogą być stopniowane etapami, definiuje się jako ciśnienie 12-25 mmHg bez obecności dysfunkcji narządów.
istnieje kilka różnych typów ACS. Pierwotne ACS występuje w urazach lub katastrof chirurgicznych, które prowadzą do dużego zdarzenia krwotocznego, jak w przedstawionym przypadku.3 wtórny ACS występuje, gdy pacjenci OIOM są agresywnie resuscytowani z dużą ilością krystaloidów.4,5 mniej powszechne przyczyny wtórne obejmują duże, zajmujące przestrzeń zmiany, obrzęk jelit lub zaotrzewnowy i zapalenie trzustki. Wtórny ACS jest podstępny i często diagnozuje się po opóźnieniu, co dodatkowo komplikuje już wysoką śmiertelność.4,5
śmiertelność ACS jest spowodowana upośledzoną perfuzją narządów, a później niewydolnością narządów. W nerkach zmniejszona perfuzja nerek prowadzi do zatorów i skąpomoczu, podczas gdy zwiększenie ciśnienia w komorze powoduje bezpośrednią kompresję narządu.6,7 zwiększona odporność naczyniowa splanchnic powoduje obrzęk jelit, translokację bakterii jelitowych, hiperlaktemię i posocznicę.6,7 obciążenie wstępne serca może być zmniejszone z powodu kompresji żyły głównej dolnej, co powoduje zmniejszenie pojemności minutowej serca, podczas gdy obciążenie prawej komory zwiększa się.7 utlenowanie jest osłabione, ponieważ przepona jest popychana i zmniejsza się funkcjonalna pojemność resztkowa.Ciśnienie wewnątrzczaszkowe wzrasta również w wyniku ucisku żylnego szyjnego upośledzającego powrót żylny. Klinicznie u pacjenta występuje niedociśnienie tętnicze, niedotlenienie, ostre uszkodzenie nerek, zaburzenia stanu psychicznego, drgawki lub brak reakcji; ostatecznie pacjent doświadcza całkowitego zapaści sercowo-naczyniowej.6-8
złotym standardem diagnostyki ACS jest pomiar ciśnienia pęcherza moczowego pośrednio za pomocą cewnika moczowego.9 aby zmierzyć dokładne ciśnienie, pacjent musi być w pozycji leżącej na plecach, a pomiar wykonywany przy wydechu końcowym, z wyzerowanym przetwornikiem i zgodnie z grzebieniem biodrowym. Wykazano, że pomiar ten koreluje z bezpośrednio mierzonym ciśnieniem w jamie brzusznej.10 pomiar ciśnienia w pęcherzu co 4-6 godzin jest wystarczający u pacjentów w stanie krytycznym, narażonych na ryzyko wystąpienia ACS.
podstawą leczenia ACS jest dekompresyjna laparotomia, Zwykle wymagająca pozostawienia pacjenta z otwartym brzuchem po operacji.Inne drugorzędowe środki skracające obejmują sedację i analgezję, porażenie nerwowo – mięśniowe, dekompresję zawartości jelit za pomocą rurki nosowo-lub endogastrycznej, leki moczopędne i CRRT.11,12
śmiertelność z powodu ACS pozostaje wysoka pomimo interwencji medycznej. Podczas dekompresyjnej laparotomii skutecznie natychmiast zmniejsza ciśnienie w jamie brzusznej, procedura ta jest związana z wieloma chorobami współistniejącymi ze śmiertelnością, która nadal pozostaje do 50%.13 Może to wynikać z faktu, że w czasie dekompresyjnej laparotomii pacjenci są krytycznie chorzy, a procedura jest uważana za ostateczność.
drugą ważną kwestią do omówienia w tym przypadku jest dylemat etyczny, przed którym stoją dostawcy opieki nad tą krytycznie chorą pacjentką, której przekonania religijne były sprzeczne ze standardowym leczeniem (transfuzja produktu krwi) jej choroby. Pacjentka miała wstępną dokumentację w karcie rozmowy lekarz-pacjent, podczas której stwierdzała świadomą odmowę przyjmowania produktów krwiopochodnych. Jednak nie ma pisemnej, podpisanej dokumentacji produktu krwi-odmowa transfuzji w karcie. Podczas gdy pacjentka była nieprzytomna i nieprzytomna, jej mąż, który nie jest praktykującym Świadkiem Jehowy, odwrócił jej decyzję, próbując uratować jej życie. Gdzie ta decyzja leży w równowadze autonomii i władzy najbliższych krewnych do decydowania o tym, jakie interwencje medyczne pacjent powinien otrzymać? Co się dzieje, gdy najbliższy krewny podejmuje decyzję, która jest niezgodna z wyborem pacjenta? W sytuacjach życiowych lub śmiertelnych z dylematami etycznymi,w których szybkie podejmowanie decyzji decyduje o wyniku pacjenta, w jaki sposób można obciążyć bliskich?
dylemat etyczny polega zatem na tym, że podczas gdy transfuzja narusza wartość autonomii, jednocześnie spełnia etyczną koncepcję dobroczynności. Ogólnie rzecz biorąc, osobiste dyrektywy pacjentów powinny mieć pierwszeństwo przed wszelkimi decyzjami podejmowanymi przez pełnomocnika medycznego. Jednak decyzja rodziny o transfuzji w imieniu nieprzytomnego pacjenta, jak widać w obecnym przypadku, jest prawnie właściwa, mimo że narusza autonomię pacjenta.
skonsultowano się z komisją etyki po tym, jak pacjent otrzymał już masową transfuzję produktów krwiopochodnych i kontynuował dalsze transfuzje krwinek czerwonych. Komitet zalecił pacjentowi zaprzestanie transfuzji produktu krwiopochodnego pomimo zgody najbliższych krewnych. Pacjent obudził się całkowicie nienaruszony neurologicznie i został poinformowany o transfuzji krwi. Zdecydowała, że w przyszłości będzie akceptować tylko osocze banku krwi i rodzinne krwinki czerwone podczas ostrego zdarzenia. Pacjentka została wypisana do domu pięć tygodni po urazie jatrogennym.
ostateczna diagnoza
jatrogenna perforacja lewej wspólnej żyły biodrowej z powstającym zespołem przedziału brzusznego.
kluczowe punkty nauczania
ACS występuje, gdy ciśnienie w jamie brzusznej przekracza 20 mmHg I występuje uszkodzenie narządu końcowego.
pierwotne ACS jest spowodowane urazem lub operacją, ale należy pamiętać o wtórnych ACS widoczne w masywnej resuscytacji, zwłaszcza w ICUs.
złotym standardem diagnostyki ACS jest zmierzone ciśnienie pęcherza moczowego.
leczenie polega na laparotomii, a także na środkach tymczasowych, takich jak ewakuacja zawartości jelit i/lub sedacja i paraliż.
uzyskano udokumentowaną świadomą zgodę pacjenta i / lub zatwierdzenie instytucjonalnej Komisji Rewizyjnej i złożono wniosek o publikację niniejszego raportu przypadku.
Przypisy
Redaktor Sekcji: Rick A. McPheeters, DO
Pełny tekst dostępny za pośrednictwem otwartego dostępu pod adresem http://escholarship.org/uc/uciem_cpcem
adres do korespondencji: Laura J. Bontempo, MD, MEd, University of Maryland, Department of Emergency Medicine, 110 S Paca Street, 6th Floor, Suite 200, Baltimore, MD 21201. E-mail: [email protected]. 2:103 – 108
historia zgłoszeń: weryfikacja otrzymana 22 stycznia 2018 r.; przesłana 19 marca 2018 r.; zaakceptowana 21 marca 2018 r.
: Na mocy umowy CPC-EM Article submission agreement wszyscy autorzy są zobowiązani do ujawnienia wszystkich powiązań, źródeł finansowania i relacji finansowych lub zarządczych, które mogą być postrzegane jako potencjalne źródła stronniczości. Autorzy nie ujawnili żadnego.
1. Pafitanis G, Spyridon K, Theodorakopoulou e, et al. Opis przypadku zespołu przedziału brzusznego spowodowanego nieprawidłowym położeniem cewnika żylnego kości udowej. Int J Surg Case Rep. 2015;12: 84-6.
2. Maluso P, Olson J, Sarani B. nadciśnienie tętnicze i zespół przedziału brzusznego. Crit Care Clin. 2016;32(2):213-22.
3. Morken J, West MA. Zespół przedziału brzusznego na oddziale intensywnej terapii. Curr Opin Crit Care. 2001;7(4):268-74.
4. Biffl WL, Moore EE, Burch JM, et al. Zespół wtórnego przedziału brzusznego jest wysoce śmiertelnym zdarzeniem. Am J. 2001;182(6): 645-8.
5. Burrows R, Edington J, Robbs JV. Wilk w ubiorze wilka: zespół przedziału brzusznego. S Afr Med J. 1995; 85(1): 46-8.
6. Caldwell CB, Ricotta JJ. Zmiany w przepływie krwi trzewnej z podwyższonym ciśnieniem wewnątrzbrzusznym. J Surg Res. 1987;43(1):14-20.
7. Balogh z, McKinley BA, Cox CS, et al. Zespół ciasnoty brzusznej: przyczyna lub skutek postinjury niewydolności wielonarządowej. Szok. 2003;20(6):483-92.
8. Vidal MG, Ruiz Weisser J, Gonzalez F, et al. Częstość występowania i skutki kliniczne nadciśnienia w jamie brzusznej u pacjentów w stanie krytycznym. Crit Care Med. 2008;36(6):1823-31.
9. Kron IL, Harman PK, Nolan Sp. z o. o. Pomiar ciśnienia w jamie brzusznej jako kryterium ponownego badania jamy brzusznej. Ann Surg. 1984;199(1):28-30.
10. Saggi BH, Sugerman HJ, Ivatury RR, et al. Zespół przedziału brzusznego. J Trauma. 1998;45(3):597-609.
11. Kirpatrick AW, Roberts DJ, De Waele JD, et al. Nadciśnienie tętnicze w jamie brzusznej i zespół ciasnoty brzusznej: zaktualizowane definicje concensus i wytyczne praktyki klinicznej z World Society of the Abdominal Compartment Syndrome. Intensive Care Med. 2013;39(7):1190-206.
12. Ouellet JF, Leppaniemi a, Ball CG, et al. Alternatywa dla formalnej dekompresji brzucha. Am 2011; 77 (Sl): S51-7.
13. De Waele JJ, Hoste EA, Malbrain ML. Laparotomia dekompresyjna w zespole przedziału brzusznego-analiza krytyczna. Opieka Krytyczna. 2006; 10(2): R51.