Introduction
adaptacyjne promieniowanie owadów w różnych klimatach zostało ułatwione częściowo przez powtarzającą się ewolucję diapauzy, przewidujące zatrzymanie rozwoju przed niekorzystnymi warunkami (np. zima, pora sucha; Waterhouse and Norris, 1980; Tauber i in., 1986; Danks, 1987; Hodkova i Hodek, 2004). Diapauza jest zazwyczaj inicjowana w odpowiedzi na symboliczny sygnał środowiskowy (np., sezonowa zmiana fotoperiodu), utrzymywana przez genetycznie określony okres, a następnie rozwiązywana po powrocie sprzyjających warunków. Tak więc diapauza pozwala owadom dostosować ich wzrost i rozmnażanie do lokalnych cykli sezonowych (Tauber et al., 1986; Danks, 1987). Diapause jest kluczowym regulatorem historii życia, zasięgu geograficznego i sezonowej obfitości dla wielu owadów zapylających (np Kemp and Bosch, 2005; Fründ et al., 2013), szkodniki rolnicze (np. Pullin et al., 1991; Li et al., 2012; Levine et al. Denlinger and Armbruster, 2014; Gray et al., 2016). Dodatkowo diapauza wywołuje powszechne zmiany fizjologiczne, w tym gromadzenie rezerw składników odżywczych, tłumienie aktywności metabolicznej, zwiększony katabolizm beztlenowy, zatrzymanie cyklu komórkowego, zmiany w sygnalizacji Wnt i regulacja różnych mechanizmów tolerancji na stres (Denlinger, 2002; Hahn and Denlinger, 2007, 2011; King and MacRae, 2015; Ragland and Keep, 2017). Zrozumienie mechanizmów regulacyjnych leżących u podstaw diapauzy jest od dawna problemem w biologii organizmalnej i ułatwi rozwój nowych podejść do zarządzania kluczowymi gatunkami.
Ekdysteroidy i hormony młodociane regulują szeroki zakres procesów fizjologicznych i rozwojowych u owadów (Gruntenko and Rauschenbach, 2008; Jindra et al., 2013; Palli, 2016), w tym diapause (Denlinger, 1985; Denlinger et al., 2012). Diapauza regulująca specyficzny sygnał hormonalny różni się w zależności od etapu, na którym występuje zatrzymanie rozwoju (Denlinger et al., 2012). Na przykład zatrzymanie rozwoju podczas diapauzy larwalnej lub poczwarkowej jest zwykle regulowane przez zmiany w obfitości ekdysteroidów (np. Ohtaki and Takahashi, 1972; Bowen et al., 1984; Richard et al., 1987). W przeciwieństwie do tego, zatrzymanie rozwoju podczas diapauzy dorosłych jest często regulowane przez zmiany w obfitości hormonów młodocianych (na przykład, Spielman, 1974; Schooneveld et al., 1977; Saunders et al., 1990 i zobacz recenzję w Denlinger et al., 2012).
istnieje duża luka w naszym zrozumieniu hormonalnej regulacji diapauzy embrionalnej, która jest szeroko obserwowana w Lepidoptera, Orthoptera, Hemiptera i Diptera. Wcześniejsze badania szeroko udokumentowały regulację endokrynologiczną diapauzy embrionalnej w ćmie jedwabnika (Bombyx mori) przez hormon diapauzy (Hasegawa, 1963; Yamashita i Hasegawa, 1966; Yamashita, 1996). Jednak ta rola regulacyjna dla hormonu diapauzy wydaje się być unikalna dla B. mori, a tym samym zapewnia niewielki wgląd w hormonalne podstawy diapauzy embrionalnej u innych gatunków (Denlinger et al., 2012). Poza B. mori, u zaledwie trzech gatunków stwierdzono hormonalną regulację diapauzy zarodkowej. Ćma cygańska (lymantria dispar)przechodzi zatrzymanie rozwoju zainicjowane i utrzymywane przez większą obfitość ekdysteroidów (Lee et al., 1997; Lee and Denlinger, 1997) podczas gdy niska obfitość ekdysteroidów reguluje diapauzę u dwóch szarańczy (Chortoicetes terminifera, Locusta migratoria; Gregg et al., 1987; Tawfik et al., 2002).
do tej pory żadne badanie nie scharakteryzowało obfitości hormonów podczas diapauzy zarodkowej żadnego gatunku Dipteranu. Tutaj zajmujemy się tą luką, badając hormonalną regulację diapauzy embrionalnej u azjatyckiego komara tygrysiego, Aedes albopictus. W ciągu ostatnich 30 lat, ten medycznie ważny wektor (Paupy et al., 2009) z powodzeniem opanował umiarkowane regiony na całym świecie (Benedict et al., 2007) częściowo z powodu diapauzy embrionalnej, która ułatwiła przetrwanie podczas transportu na duże odległości (Juliano and Lounibos, 2005; Diniz et al., 2017) i szybko ewoluowały, aby dostosować czas zatrzymania rozwoju do lokalnych warunków klimatycznych (Urbanski et al., 2012). Umiarkowane populacje Ae. albopictus wchodzi w matczyną, fotoperiodyczną diapauzę. W krótkich, jesiennych dniach samice produkują jaja, które kończą rozwój embrionalny, ale pozostają oporne na bodźce wylęgowe jako larwy wewnątrz kosmówki jaja do następnej wiosny. W ciągu ostatniej dekady transkrypcyjna Regulacja diapauzy embrionalnej w Ae. albopictus został szeroko scharakteryzowany (Urbanski et al., 2010; Poelchau et al.,2011, 2013a, b; Huang X. et al., 2015; Batz et al., 2017), ale regulacja hormonalna tej kluczowej adaptacji pozostaje nieznana. Określiliśmy ilościowo 20-hydroksyecdyson (20he) i młodzieńczy hormon III (JH3) w jajach diapauzujących i nie diapauzujących w trzech punktach czasowych, które obejmują kluczowe etapy rozwoju embrionalnego i zinterpretowaliśmy nasze wyniki w kontekście wcześniej zebranych RNAseq (Poelchau et al., 2013a, b) i danych manipulacyjnych (Suman et al., 2015).
materiały i metody
zbieranie jaj
we wszystkich pomiarach wykorzystano jaja F11 z Kolonii laboratoryjnej Ae. albopictus utworzony w sierpniu 2015 z ponad 200 larw zebranych w Manassas, VA, Stany Zjednoczone. Przed tym eksperymentem populacja utrzymywała się w wcześniej opisanych warunkach . Aby wygenerować próbki jaj do tego eksperymentu, larwy F10 trzymano w pojemnikach Sterlitowych o pojemności 5,5 L przy gęstości około 250 larw na 2.5 L wody dejonizowanej (DI) z 5 mL zawiesiny pokarmowej (Armbruster i Conn, 2006) pod FOTOPERIODEM LD w temperaturze 21°C i 80% WILGOTNOŚCI WZGLĘDNEJ. W każdy poniedziałek–środę–piątek larwy filtrowano przez drobną siatkę, a następnie przenoszono do czystego pojemnika Sterlite o pojemności 5,5 L; poczwarki rozprowadzano do klatek dla dorosłych utrzymywanych w fotoperiodzie LD zapobiegającym diapauzie lub w fotoperiodzie indukującym diapauzę (SD, 8:16 L:D).
dorosłym kobietom dostarczano cotygodniowe krwawe plamy i kubek do jajeczkowania wyłożony niebielonym ręcznikiem papierowym i do połowy wypełniony wodą DI, aż jajeczkowanie ustało. Jaja zbierano codziennie, trzymano na mokrym ręczniku papierowym przez 48 h, a następnie suszono na powietrzu i przechowywano w pojemnikach w Warunkach SD. Po 5, 7 i 11 dniach od jajeczkowania (dpov) zbierane jaja ważono z dokładnością do 1 µg (średnia: 11,460 mg, zakres: 9,1–19,5 mg) na mikrowaga MX5 (Mettler-Toledo, Columbia, OH, Stany Zjednoczone), umieszczano w probówkach o pojemności 1,5 mL, zamroziono w ciekłym azocie między godziną 11: 00 a 23: 00 (Czas Zeitgebera 3-4 godziny) i przechowywano w temperaturze -80°C. Zachowano podzbiór jaj, aby potwierdzić, że Warunki fotoperiodu LD i SD stymulowały produkcję odpowiednio jaj bez diapauzy i diapauzy (patrz Urbanski et al., 2012).
próbkowaliśmy jajka w 5, 7 i 11 dpov z dwóch powodów. Po Pierwsze, Ae. albopictus inicjuje diapauzę (sensu Koštál, 2006; Koštál et al., 2017) po zakończeniu rozwoju embrionalnego (Mori et al., 1981). W Warunkach wykorzystywanych w naszych eksperymentach, Ae. zarodki albopictus ulegają segmentacji w przybliżeniu w 5 dpov, a zarodki bez diapauzy są właściwe do wylęgu w przybliżeniu w 7 dpov(Poelchau et al., 2013a). Do 11 dpov zatrzymanie rozwoju jest mocno ustalone w zarodkach diapauzalnych (Poelchau et al., 2013b). W związku z tym zdecydowaliśmy się porównać zarodki diapauzalne i niediapauzalne w punktach czasowych obejmujących okres zdolności wylęgu, w tym ustalenie zatrzymania rozwoju podczas diapauzy. Po drugie, wybraliśmy punkty czasowe, które były podobne do tych stosowanych w poprzednich eksperymentach rnaseq zarodków (poelchau et al., 2013a, b) aby te dane mogły być wykorzystane do interpretacji naszych aktualnych wyników. Te wyniki RNAseq były wcześniej dobrze skorelowane z wynikami ekspresji genów uzyskanymi za pomocą qRT-PCR (Poelchau et al., 2013a).
oznaczanie ilościowe Ecdysteroidów
aby wyodrębnić ecdysteroidy, próbki jaj umieszczono w rurce ze szkła borokrzemianowego o pojemności 0,5 mL (Wheaton, Millville, NJ, Stany Zjednoczone) z dodatkiem 1 µg farnezolu (Sigma-Aldrich, St.Louis, MO, Stany Zjednoczone) jako standard wewnętrzny. Jaja ręcznie homogenizowano trzy razy tłuczkiem z teflonu w schłodzonym MeOH klasy HPLC o pojemności 300 µL, a następnie wirowano w temperaturze 12 000 RCF przez 10 minut w wirówce chłodzonej (4°C). Otrzymany supernatant połączono, a następnie eluowano przez kolumny tlenku glinu dwukrotnie schłodzonym 90% MeOH i raz z MeOH. Próbki wysuszono w chłodzonej (4°C) wirówce próżniowej, zawieszono w 20 µL MeOH i przechowywano w temperaturze -80°C do czasu analizy. Kontrole pozytywne przygotowano przez dodanie 1 µg każdego z 20HE (Sigma-Aldrich) i farnezolu do pustych probówek, które w inny sposób były przetwarzane identycznie. Przykładową analizę stężenia ekdysteroidów wykonano za pomocą mikromasażu Quattro Micro LC-MS / MS (Waters Co., Milford, MA, Stany Zjednoczone). Objętość wtrysku wynosiła 5,0 µL, przy czym separacje przeprowadzono przy użyciu kolumn ACQUITY UPLC BEH C18 2,1 mm na 50 mm z fazą stacjonarną 1,7 µm (Waters Co.). Warunki pracy dla przebiegów LC były ruchome natężenie przepływu fazy 0,37 mL min-1 z podwójną fazą ruchomą 0,1% kwasu mrówkowego w acetonitrylu i 0,1% kwasu mrówkowego w wodzie. Warunki początkowe wynosiły 1:99 acetonitryl: woda, a następnie przepływ izokratyczny przez 0,3 min. Przy 0,3 min, gradient liniowy od 1:99 do 99: 1 acetonitryl: wodę nakładano przez 4,2 min, a następnie 1,0 min izokratyczny przepływ przy 99: 1 acetonitryl: woda, po czym Faza ruchoma powróciła do 1: 99 acetonitryl: woda. Ustawienia spektrometru masowego były elektrospray dodatnie, z temperaturą desolwatacji 350°C. 20he i Farnezol eluowano odpowiednio w 2,89 i 4,97 min i oznaczano ilościowo, stosując wielokrotne monitorowanie reakcji charakterystycznych przejść: 481,22 (m/z) > 445,24 (m/z) i 205,41 (m/z) > 121,09 (m/z), odpowiednio. Granica wykrywalności testu wynosi około 5 pg.
kwantyfikacja hormonów młodzieńczych
każdą próbkę jaj umieszcza się w rurce ze szkła borokrzemianowego o pojemności 0,5 mL ze stożkowym dnem (Wheaton) z dodatkiem 1 µg farnezolu (Sigma-Aldrich) jako wewnętrznego wzorca. Jaja ręcznie homogenizowano trzy razy tłuczkiem z teflonu w schłodzonym heksanie o pojemności 500 µL HPLC, a następnie wirowano w temperaturze 12 000 RCF przez 10 minut w wirówce chłodzonej (4°C). Frakcje heksanu rekombinowano w czystej fiolce ze szkła borokrzemianowego i osuszono przez odwirowanie próżniowe. JH oznaczano ilościowo za pomocą chromatografii gazowej/spektrometrii mas, jak opisano wcześniej (Brent i Vargo, 2003). Krótko, pozostałość przemyto z fiolek trzema płukaniami heksanu i dodano do kolumn ze szkła borokrzemianowego wypełnionych tlenkiem glinu. Aby odfiltrować zanieczyszczenia, próbki eluowano przez kolumny kolejno heksanem, 10% eterem etylowym-heksanem i 30% eterem etylowym-heksanem. Po wysuszeniu próbki derywatyzowano przez ogrzewanie w temperaturze 60°C przez 20 minut w roztworze alkoholu metylo-D (Sigma-Aldrich) i kwasu trifluorooctowego (Sigma-Aldrich). Próbki wysuszono, zawieszono w heksanie i ponownie eluowano przez kolumny tlenku glinu. Składniki nierozdywatyzowane usunięto 30% eterem etylowym. Pochodną JH zebrano do nowych fiolek przez dodanie 50% octanu etylu-heksanu. Po wyschnięciu próbki ponownie zawieszono w heksanie, a następnie przeanalizowano za pomocą HP 7890a series GC (Agilent Technologies, Santa Clara, CA, Stany Zjednoczone) wyposażonego w kolumnę Zebron ZB-WAX o wymiarach 30 m × 0,25 mm (Phenomenex, Torrance, CA, Stany Zjednoczone) połączoną z detektorem selektywnej masy obojętnej HP 5975c. Hel był używany jako gaz nośny. Postać JH została potwierdzona przez pierwsze próby testowe w trybie skanowania pod kątem znanych sygnatur JH 0, JH I, JH II, JH3 i JH3 etylu; JH3 potwierdzono jako pierwotną postać endogenną u tego gatunku. Kolejne Próbki analizowano w trybie MS SIM, monitorując przy m/z 76 i 225 w celu zapewnienia swoistości dla pochodnej D3-metoksyhydryny JH3. Całkowita liczebność została określona ilościowo na podstawie standardowej krzywej derywatyzowanego JH3 i dostosowana do początkowej masy jaj. Granica wykrywalności testu wynosi około 1 str.
analizy statystyczne
przeprowadzono w R (R Core Team, 2019). Obfitość JH3 została przekształcona logiem i przeanalizowana przy użyciu ANOVA w celu sprawdzenia skutków stanu diapauzy, wieku i ich interakcji. 20obecność była nieliniowa i dopasowana przy użyciu dwóch wielomianowych modeli regresji: pełnego modelu obejmującego wiek i stan rozwojowy (diapauza, nie-diapauza) oraz zredukowanego modelu zawierającego tylko wiek. Modele porównano przy użyciu ANOVA w celu określenia, czy włączenie stanu rozwojowego znacząco poprawiło moc wyjaśniającą.
analizy transkrypcyjne wykorzystywały wcześniej zebrane dane RNAseq z okresu Ae diapauzalnego i Niediapauzalnego. jaja albopictus (uzupełniający zbiór danych 1; Poelchau et al., 2013a, b). Differentially expressed genes at 3, 6 i 11 dpov badano za pomocą analiz wzbogacania zestawu genów (Mootha et al., 2003) za pomocą pakietu fortepianowego (Väremo et al., 2013) Ustaw domyślne parametry, a następnie korektę FDR. Zestaw genów referencyjnych został opatrzony adnotacjami dotyczącymi procesu biologicznego, przypisanymi do bazy wektorowej (Giraldo-Calderón et al., 2015). Geny szlaku syntezy JH3 i ecdysteroidów, a także receptory JH3 i geny degradacji zostały ręcznie przypisane zgodnie z wcześniejszą literaturą (Bai et al., 2007; Li et al., 2011; Nouzova et al., 2011; Niwa i Niwa, 2014; Matthews et al., 2016). Dodatkowo opisaliśmy geny indukujące JH3 i ecdysteroid na podstawie opisów genów dostarczonych w bazie VectorBase (Giraldo-Calderón et al., 2015). Pełny przegląd tych zestawów genów znajduje się w dodatkowym zestawie danych 1.
wyniki
średnia częstość diapauzy wynosiła 95,9% (zakres: 90,5–100%) W przypadku fotoperiodu SD i 5.4% (Zakres: 1,8–9,5%) pod fotoperiodem LD (dodatkowy zestaw danych 2); Tak więc nasze zabiegi fotoperiodowe wywołały oczekiwaną reakcję diapauzy. 20he osiągnął szczyt zarówno w Warunkach diapauzy, jak i nie diapauzy w 7 dpov, ale włączenie statusu diapauzy jako czynnika w modelu kwadratowym dla obfitości 20he nie poprawiło mocy wyjaśniającej modelu (Fig. 1a i uzupełniający zestaw danych 3; F3, 43 = 0,21, p = 0,890). Wyniki te wskazują, że stan diapauzy nie wyjaśnia znacząco zmiany miana 20he. Analiza szlaku RNAseq wykazała, że ani szlak syntezy 20he, ani geny indukowalne 20he nie uległy znaczącej zmianie w Warunkach diapauzy w porównaniu z warunkami Nie diapauzy w 3, 6 lub 11 dpov(Tabela 1).

Tabela 1. Wyniki analizy wzbogacania zestawu genów, patrz uzupełniający zestaw danych 1, Aby uzyskać pełne podsumowanie tych zestawów genów.
potwierdzono, że JH3 jest podstawową formą hormonu młodzieńczego u tego gatunku. Liczebność JH3 była znacząco zmniejszona u zarodków diapauzalnych (Fig. 1B i dodatkowy zestaw danych 3; F1,64 = 5,08, p = 0,028). Jednak wiek (F2,64 = 0, 66,p = 0, 518) i interakcja stanu diapauzy z wiekiem (F2, 64 = 0, 13, p = 0, 883) nie wpływały na stężenie JH3. Analiza Szlaku z danych RNAseq wykazała, że szlak syntezy JH3 był znacząco represjonowany w 3 dpov, a geny indukujące JH były znacząco represjonowane w 6 dpov (fig.2 I Tabela 1).
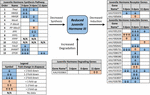
Rysunek 2. Podsumowanie ekspresji różnicowej genów biorących udział w syntezie JH3, degradacji i indukcji Ae. albopictus (Poelchau et al., 2013a, b). Znaczne zmniejszenie indukowane diapauzą (niebieski) lub wzrost (pomarańczowy) są wskazywane przez zacienione komórki. Różnica wielkości jest wskazywana strzałkami opisanymi w legendzie w lewym dolnym rogu. ∗Geny bez nazw zwyczajowych są identyfikowane za pomocą numeru identyfikacyjnego VectorBase.
dyskusja
Diapauza jest powszechną adaptacją, która pozwala owadom dostosować ich wzrost i rozmnażanie do warunków sezonowo korzystnych (Tauber et al., 1986; Danks, 1987). Zrozumienie zmian hormonalnych, dzięki którym owady koordynują postrzeganie zewnętrznych sygnałów wywołujących diapauzę z mechanizmami fizjologicznymi, które prowadzą do zatrzymania rozwoju, jest od dawna celem w biologii (Lees, 1956; Denlinger, 2002). Dziesięciolecia badań doprowadziły do identyfikacji wspólnych strategii hormonalnych diapauzy na etapie larwalnym, poczwarkowym i dorosłym; jednak regulacja hormonalna diapauzy embrionalnej pozostaje w dużej mierze nieznana, szczególnie w Diptera (Denlinger, 1985, 2002; Denlinger et al., 2012). W tym badaniu nasz bezpośredni pomiar zmniejszonej obfitości JH3 w diapauzie jest potwierdzony przez wcześniejsze profilowanie ekspresji genów (Poelchau et al., 2013a, b) i eksperymenty manipulacyjne (Suman et al., 2015) popierając hipotezę, że JH3 reguluje diapauzę embrionalną u tego gatunku.
Ekdysteroidy
w niniejszym badaniu bezpośrednio zmierzyliśmy obfitość ekdysteroidów w trzech punktach czasowych w Warunkach diapauzy i nie diapauzy u zarodków komara Ae. albopictus. Zgodnie z wcześniejszymi wynikami Toxorhynchites amboinensis (Russo And Westbrook, 1986), poziom 20he osiągnął szczyt blisko zakończenia rozwoju embrionalnego (7 dpov; ryc. 1a). Jednak miano 20he nie różniło się znacząco między jajami diapauzalnymi i nie diapauzalnymi. Ponadto ani szlak syntezy 20HE, ani geny indukowalne 20HE nie uległy znaczącym, skoordynowanym zmianom w ekspresji genów (Tabela 1). Wnioskujemy, że w przeciwieństwie do wcześniej zbadanych diapauz zarodkowych u Lepidoptera i Orthoptera (Hasegawa, 1963; Yamashita and Hasegawa, 1966; Gregg et al., 1987; Yamashita, 1996; Lee and Denlinger, 1997; Lee et al., 1997; Tawfik et al., 2002), 2002 nie reguluje inicjacji diapauzy w Ae. albopictus.
hormon młodzieńczy
w przeciwieństwie do tego, zaobserwowaliśmy około dwukrotnie mniejszą obfitość JH3 w zarodkach diapauzalnych (ryc. 1B). Podczas gdy mniejsza wielkość niż różnice w obfitości JH3 wykryte w Warunkach diapauzy vs. Nie-diapauzy u owadów, które diapauzy w innych stadiach życia (np Yin i Chippendale, 1979; Walker i Denlinger, 1980; Readio et al., 1999), nasze bezpośrednie pomiary są potwierdzone przez dowody transkrypcyjne (Rysunek 2). Na przykład szlak syntezy JH3 jest znacznie tłumiony podczas wczesnego przygotowania diapauzy (3 dpov). Wspierając naszą interpretację tych wyników, poprzednie badania wykazały, że zmniejszona ekspresja genów wzdłuż szlaku syntezy JH3 jest silnie skorelowana z niższą obfitością JH3 w obu Aedes aegypti (Nouzova et al., 2011; Rivera-Perez et al., 2014) i Diploptera punctata (Huang J. et al., 2015). Indukowane przez JH geny są również znacząco tłumione podczas późnego przygotowania diapauzy (6 dpov; Tabela 1), co sugeruje, że zarodki przeznaczone do diapauzy mają ograniczoną zdolność do odpowiedzi na sygnalizację JH3 w pobliżu czasu, w którym zarodki niediapauzalne stają się kompetentne do wylęgu. Ponadto ekspresja genu dla enzymu rozkładającego JH3 (esteraza JH) jest znacząco zwiększona we wczesnym podtrzymywaniu diapauzy (11 dpov; fig.2), Jak również później w podtrzymywaniu diapauzy (21 i 40 Dpov; Poelchau i in., 2013b), co sugeruje, że JH3 może pozostać na niskim poziomie przez cały okres diapauzy u tego gatunku.
zmniejszenie obfitości JH3 podczas zatrzymania rozwoju jest nieco sprzeczne z intuicją, ponieważ niskie miano hormonu młodzieńczego jest zwykle związane z postępującymi moltami, szczególnie od larw do stadium poczwarki (Palli, 2016). Jednak zastosowanie analogu JH3 (pyriproksyfen) do diapauzy Ae. jaja albopictus przyspiesza tempo zakończenia diapauzy w sposób zależny od dawki(Suman et al., 2015). Przy najskuteczniejszej dawce około 80% jaj narażonych na piryproksyfen kończy diapauzę o 30 dpov w porównaniu do zaledwie 1% diapauzy zakończonej o 80 dpov dla jaj kontrolnych (Suman i wsp., 2015). Zmiany w obfitości JH3 mogą również generować embrionalny fenotyp podobny do diapauzy u innych gatunków. Na przykład w B. mori, eksperymentalna redukcja syntezy JH3 przez nokaut JHAMTA powoduje w pełni rozwinięte larwy pharate, które nie reagują na bodźce wylęgowe; ten fenotyp można uratować w sposób zależny od dawki przez zastosowanie ekstrahowanego JH3 lub metoprenu, analogu JH3 (Nakao et al., 2015). Podobnie, eksperymentalna suplementacja innego analogu hormonu młodzieńczego (RO-20-3600) do nowo zdeponowanych jaj Drosophila melanogaster wytwarza larwy pharate, które są mobilne w jajku, ale nie wykluwają się (Smith and Arking, 1975). Łącznie dane te wskazują, że liczebność hormonów młodocianych prawdopodobnie przyczynia się do regulacji odpowiedzi wylęgowych u różnych owadów. Diapauza zarodkowa na etapie larwalnym gardła jest definiowana przez brak reakcji na bodźce wylęgowe, dlatego zmiany w obfitości hormonów młodocianych mogą stanowić powszechną strategię hormonalną regulującą tę formę diapauzy.
w zgodzie z wcześniejszymi danymi transkrypcyjnymi i manipulacyjnymi, nasze wyniki silnie implikują zmniejszoną obfitość JH3 jako prawdopodobny regulator diapauzy embrionalnej w Ae. albopictus. Badanie to jest pierwszym bezpośrednim oznaczeniem ilościowym obfitości hormonów podczas diapauzy embrionalnej u dowolnego gatunku Dipteranu i stanowi ważny krok w kierunku wyjaśnienia regulacji hormonalnej tej kluczowej adaptacji do niekorzystnych środowisk. Scharakteryzowanie związku między bodźcami zewnętrznymi a zatrzymaniem rozwoju poprzez sygnalizację hormonalną pozostaje głównym wyzwaniem (Denlinger, 1985; Denlinger et al., 2012). Wyjaśnienie tych ścieżek w różnych gatunkach zapewni krytyczny wgląd w podstawowe i stosowane problemy, w tym zrozumienie molekularnych i fizjologicznych podstaw ewolucji historii życia, przewidywanie reakcji gatunków na zmiany klimatyczne i określenie nowych celów zarządzania szkodnikami i gatunkami wektorowymi (Denlinger, 2008).
Oświadczenie o dostępności danych
wszystkie zbiory danych wygenerowane dla tego badania są zawarte w artykule/materiale uzupełniającym.
wkład autora
ZB, CB i PA przyczyniły się do koncepcji, projektu opracowania i przygotowały wstępny projekt rękopisu. ZB, MM i JS przeprowadzili hodowlę zwierząt i pobrali próbki jaj. CB wykonało analizy LC-MS / MS i GC-MS. ZB przeprowadził analizy statystyczne. Wszyscy autorzy wnieśli swój wkład w rewizję manuskryptu i zaakceptowali nadesłaną wersję.
finansowanie
ta praca była wspierana przez National Institutes of Health (1R15A|111328-01) i darowiznę rodziny Davis dla PA.
konflikt interesów
autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
Dziękujemy Allanowi Knopfowi i Danowi Langhorstowi za pomoc w pomiarze miana hormonów. Dziękujemy również Davidowi Denlingerowi za pomocne komentarze na temat wcześniejszych wersji rękopisu. Używanie nazw handlowych lub produktów handlowych w niniejszym artykule służy wyłącznie do dostarczania konkretnych informacji i nie oznacza rekomendacji lub poparcia przez Departament Rolnictwa Stanów Zjednoczonych. USDA jest dostawcą równych szans i pracodawcą.
Materiał Uzupełniający
R Core Team (2019). R: język i Środowisko do obliczeń statystycznych. Wiedeń: R Core Team.
Google Scholar
Väremo, L., Nielsen, J., and Nookaew, I. (2013). Wzbogacenie analizy zestawu genów danych dotyczących całego genomu poprzez włączenie kierunkowości ekspresji genów oraz połączenie hipotez i metod statystycznych. Nucleic Acids Res. 41, 4378-4391. doi: 10.1093/nar / gkt111
PubMed Abstract / CrossRef Full Text / Google Scholar