inne informacje
Literatura
reakcje pokrewne
synteza estru Acetooctowego
synteza estru malonowego

kondensacja związków kwasu węglowego z aldehydami w celu uzyskania α, β-związków nienasyconych.
modyfikacja Doebnera, która jest możliwa w obecności grup kwasów karboksylowych, obejmuje dekarboksylację indukowaną pirydyną.
mechanizm kondensacji Knoevenagela
powstaje półprodukt enol:

ten enol reaguje z aldehydem, a otrzymany aldol ulega dalszej eliminacji indukowanej zasadą:

rozsądna zmiana mechanizmu, w którym piperydyna działa jako organokatalizator, obejmuje odpowiedni związek pośredni iminium jako akceptor:
modyfikacja Doebnera w refluxingu efektów pirydyny, dekarboksylacja i eliminacja:

najnowsza Literatura

synteza Akrylamidów za pomocą kondensacji Doebnera-Knoevenagela
M. J. Zacuto, J. Org. Chem., 2019, 84, 6465-6474.

Facile and Highly Stereoselective One – Pot Synthesis of E)-or (Z) – Nitro Alkenes
S. Fioravanti, L. Pellacani, P. A. Tardella, M. C. Vergari, Org. Lett., 2008,10, 1449-1451.

Phosphane-Catalyzed Knoevenagel Condensation: a Facile Synthesis ofa-Cyjanoacrylanes and α-Cyjanoacrylonitriles
J. S. Yadav, B. S. S. Reddy, A. K. Basak, B. Visali, A. V. Narsaiah, K. Nagaiah, Eur. J. Org. Chem., 2004, 546-551.

zrekonstruowany Hydrotalcyt jako wysoce aktywny heterogeniczny katalizator zasadowy do tworzenia wiązań węgiel-węgiel w obecności wody
K. Ebitani, K. Motokura, K. Mori, T. Mizugaki, K. Kaneda, J. Org. Chem., 2006, 71, 5440-5447.

Ind (III)-katalizowana kondensacja Knoevenagela aldehydów i aktywowanych Metylenów przy użyciu bezwodnika octowego jako promotora
Y. Ogiwara, K. Takahashi, T. Kitazawa, N. Sakai, J. Org. Chem., 2015,80, 3101-3110.

ciekły jonowy tetrafluoroboran 1-butylo-3-metyloimidazoniowy BF4 został użyty do katalizowanej dioctanem etylenodiamonu (EDDA) kondensacji Knoevenagela między aldehydami lub ketonami z aktywnymi związkami metylenowymi. Katalizator i rozpuszczalnik można poddać recyklingowi.
C. Su, Z.-C. Chen, Q.-G. Zhen, Synteza,2003, 555-559.

ciecz jonowa jako katalizator i medium reakcyjne-prosta, wydajna i ekologiczna procedura kondensacji Knoevenagela alifatycznych i aromatycznych związków karbonylowych przy użyciu specyficznej dla zadania podstawowej cieczy jonowej
B. C. Ranu, R. Jana, Eur. J. Org. Chem., 2006, 3767-3770.

Organicatalytic Knoevenagel Condensations by Means of Carbamic Acid Ammonium Soles
N. Mase, T. Horibe, Org. Lett., 2013,15, 1854-1857.

gem-Dibromomethylarenes: a Convenient Substitute for Noncommercial aldehydy in the Knoevenagel-Doebner Reaction for the Synthesis of α, β-Unsaturated Carboxylic Acids
J. K. Augustine, Y. A. Naik, A. B. Mandal, N. Chowdappa, V. B. Praveen, J. Org. Chem., 2007,72, 9854-9856.
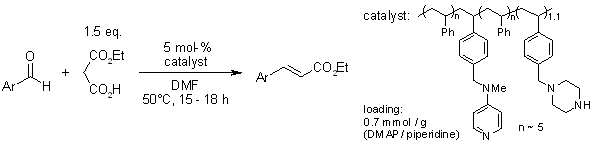
Organocatalytic Decarboxylative Doebner-Knoevenagel Reactions between Arylaldehydes and Monoethyl Malonate Mediated by a Bifunctional Polymeric Catalyst
J. Lu, P. H. Toy, Synlett, 2011, 1723-1726.

Base-Promoted Cascade Approach for the Preparation of Reduced Knoevenagel Adducts Using Hantzsch Esters as Reducing Agent in Water
T. He, R. Shi, Y. Gong, G. Jiang, M. Liu, S. Qian, Z. Wang, Synlett, 2016, 27, 1864-1869.

praktyczny i wygodny protokół syntezy kwasów (e)-α,β-nienasyconych
A. R. Mohite, R. G. Bhat, Org. Lett., 2013,15, 4564-4567.

ciecz jonowa jako katalizator i medium reakcyjne-prosta, wydajna i ekologiczna procedura kondensacji Knoevenagela alifatycznych i aromatycznych związków karbonylowych przy użyciu specyficznej dla zadania podstawowej cieczy jonowej
B. C. Ranu, R. Jana, Eur. J. Org. Chem., 2006, 3767-3770.