wprowadzenie
ostry częstoskurcz pozamaciczny (JET) może pojawić się po operacji z powodu wrodzonych wad serca. Chociaż samoogranicza się w ciągu 48-72 godzin, śmiertelność w przypadku braku szybkiego leczenia wynosi 40% 1 z powodu podwyższonej częstości akcji serca (HR) i dysocjacji przedsionkowo-komorowej (AVD). Słaba reakcja na leczenie farmakologiczne doprowadziła do poszukiwania innych możliwości leczenia, w tym umiarkowanej hipotermii.2 leczenie to, opisane po raz pierwszy w 1987 r. 3, opisywano w literaturze rzadko, a wszystkie doniesienia dotyczą małej liczby pacjentów.
pacjenci i metoda
pacjenci
dokonaliśmy przeglądu dokumentacji klinicznej pacjentów operowanych z powodu wrodzonych wad serca między wrześniem 1999 r.a październikiem 2001 r. w Área Infantil del corazón (Pediatric Heart Service) kompleksu szpitalnego Juan Canalejo W A Coruña, Północno-Zachodnia Hiszpania. Zbadano standardowe elektrokardiogramy, podobnie jak elektrogramy przedsionkowe rejestrowane podczas epizodów arytmii za pomocą elektrod przedsionkowych umieszczonych podczas operacji lub elektrod przełykowych. Do badania włączono tylko pacjentów z potwierdzonym lub prawdopodobnym JET, którzy byli leczeni hipotermią.
kryteria diagnostyczne
– potwierdzone JET: a) tachykardia z kompleksem QRS podobnym do śledzenia podstawowego lub do śledzenia uzyskanego przez stymulację przedsionków, wraz z B) AVD z wolniejszą szybkością przedsionków niż częstość komór.
– prawdopodobny JET: zarejestrowano, gdy kryterium 1, Jak wspomniano powyżej, było spełnione, ale nie było możliwe wykazanie AVD, lub gdy wystąpiło przewodzenie wsteczne 1: 1, A arytmia nie reagowała na kardiowersję elektryczną lub nadmierną stymulację przedsionków.
leczenie
leczenie JET opierało się na: a) podstawowych środkach (zmniejszone stosowanie środków inotropowych, sedacja, korekta nierównowagi elektrolitowej); b) rozruszniku serca (w celu przywrócenia synchronizacji przedsionkowo-komorowej poprzez ustalenie HR szybciej niż spowodowane przez JET); C) hipotermii i D) lekach antyarytmicznych. Digoksyna była stosowana w celu wsparcia inotropowego i moczopędnego u niektórych pacjentów.
hipotermia została rozpoczęta, gdy stan hemodynamiczny pogorszył się pomimo podstawowych środków lub gdy nie było możliwe utrzymanie szybkości rozrusznika szybciej niż szybkość JET. Wszyscy pacjenci byli uspokojeni i umieszczeni na wentylacji mechanicznej środkami zwiotczającymi mięśnie. Stosowano wentylatory, zimne opakowania umieszczane na skórze i płukanie zimną solą fizjologiczną przez rurkę nosowo-żołądkową. Temperatura była obniżana, dopóki prędkość strumienia nie spadła, ale nigdy do poziomu poniżej 33 ºC, mierzonego termometrem doodbytniczym. Po co najmniej 36 godzinach stabilizacji hemodynamicznej (odpowiednie centralne ciśnienie żylne, ciśnienie tętnicze i diureza) pacjenci byli poddawani powolnemu nawracaniu (1 ºC/8 h) poprzez zwiększanie zewnętrznych źródeł ciepła pod stałym monitorowaniem elektrokardiograficznym. U pacjentów leczonych rozrusznikiem serca leczenie to zostało przerwane, gdy pojawił się prawidłowy rytm zatokowy lub gdy tempo odrzutów zmniejszyło się poniżej 75.percentyla normalności w zależności od wieku.
analiza statystyczna
zmienne ilościowe są wyrażone jako średnia±odchylenie standardowe, a mediana jest również podawana dla zmiennych, których rozkład był wyraźnie asymetryczny. Zmienne kategoryczne są wyrażone jako wartości bezwzględne (procenty). Zmiany wartości hemodynamicznych uzyskane w 1, 2, 4, 8, 12 y 24 h od początku hipotermii analizowano za pomocą MANOVA pod kątem liniowych trendów dla powtarzania pomiarów; normalny rozkład danych weryfikowano wcześniej za pomocą testu Shapiro-Wilksa. Różnice uznano za istotne przy P
wyniki
łącznie 138 pacjentów poddano operacji serca pediatrycznej z pominięciem krążenia i płucnego; U 21 (15,2%) stwierdzono potwierdzony lub prawdopodobny JET, a u 12 badanych pacjentów (9 dziewcząt, średni wiek 2,1±2,0 miesiąca) zastosowano hipotermię (Tabela 1). Początek JET odnotowano 6,3±11,9 h po operacji (mediana, 2 h). W tym momencie temperatura wynosiła 37,0±0,7 °c (Tabela 2). Hipotermia rozpoczęła się 1,5±0,5 h po rozpoczęciu JET (mediana, 1,0 h) i trwała 74±42 h (Zakres, 36-144 h). Podczas hipotermii digoksynę stosowano u 6 pacjentów, a u 4 z nich amiodaron podawano również jako wsparcie podczas hipotermii. U 10 chorych zastosowano rozrusznik serca: u 9 elektrody epikardialne umieszczono na sali operacyjnej, a u 1 elektrodę przełykową.
zmiany temperatury centralnej i stanu hemodynamicznego w ciągu pierwszych 24 godzin pokazano na fig. 1. Największą poprawę uzyskano podczas pierwszych 4 godzin hipotermii, po których pacjenci pozostali stabilni.
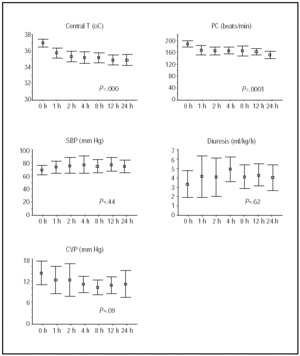
Fig. 1. Kurs podczas pierwszych 24 h hipotermii. Linie ilustrują środki I 95% przedziały ufności. Wartości P odnoszą się do testów trendów liniowych MANOVA dla powtarzanych pomiarów. HR oznacza tętno; bije / min, bije na minutę; t, temperatura; SBP, skurczowe ciśnienie krwi; CVP, centralne ciśnienie żylne.
przeżyli wszyscy pacjenci z wyjątkiem jednego. Niemowlę, które zmarło, miało niski stan wyjściowy wtórny do JET, który był oporny na leczenie. Nie stwierdzono powikłań bezpośrednio związanych z hipotermią. W czasie ponownego nagrzewania 5 pacjentów nadal miało JET; jeden wymagał ponownego chłodzenia z powodu znacznego wzrostu HR. głównie rytm zatokowy pojawił się 65±38 h po rozpoczęciu hipotermii. Dwóch z 6 pacjentów, którzy odzyskali prawidłowy rytm zatokowy podczas hipotermii, wymagało ponownego ochłodzenia, ponieważ JET i rapid HR powróciły.
11 pacjentów, którzy zostali wypisani, pozostało żywych i nie miało następstw neurologicznych po średnim okresie obserwacji wynoszącym 15±12 miesięcy (zakres, 2-36 miesięcy). Rytm zatokowy był utrzymywany bez arytmii podczas obserwacji.
dyskusja
JET pooperacyjny powstaje z ogniska pozamacicznego znajdującego się w tkance węzłowej lub wiązce jego i jest wywołany podrażnieniem mechanicznym podczas zabiegu.2 jego ektopowy charakter sprawia, że jest wrażliwy na równowagę współczulno-błędną i odporny na nadmierną stymulację przedsionków lub kardiowersję elektryczną. Wysokie HR i AVD zmniejszają pojemność minutową serca, a to z kolei przyspiesza arytmię z powodu zwiększonego napięcia adrenergicznego, tworząc w ten sposób błędne koło.1,2 ponieważ proces samoogranicza się w ciągu 48-72 h,2 głównym celem leczenia jest utrzymanie odpowiedniej wydajności serca, dopóki arytmia nie ustąpi samoistnie.
leczenie powinno obejmować1,2,4,5 korekcję zaburzeń równowagi elektrolitowej i równowagi kwasowo-zasadowej, usunięcie bodźców adrenergicznych (ból, podrażnienie, niepokój), odpowiednie uspokojenie i zmniejszenie poziomu środków inotropowych i rozszerzających naczynia krwionośne, które przyspieszają HR i JET.2 odpowiedź na leki przeciwarytmiczne jest słaba, 2 i digoksyna nie jest skuteczna.5 propafenon wydaje się mieć pewne korzyści,6 pomimo faktu, że jest to ujemny środek inotropowy. Amiodaron jest przydatny7, 8, chociaż z naszego doświadczenia może wymagać zwiększenia objętości z powodu pojawienia się niedociśnienia. Prokainamid jest skuteczny w połączeniu z hipotermią tylko wtedy, gdy sama hipotermia jest niewystarczająca.5 rola beta-blokerów jest kontrowersyjna, 2 i antagoniści wapnia nie są zalecane. Inne możliwości leczenia to różne tryby stymulacji rozrusznikami serca i szybka ablacja wiązki His w opornych przypadkach.1,2
wczesna diagnoza ma fundamentalne znaczenie. W przypadku podejrzenia JET należy wykonać 12-ołowiowy elektrokardiogram i elektrogram przedsionkowy.9 w naszej serii pacjentów, elektrografia przedsionków umożliwiła zdemaskowanie AVD U 2 pacjentów i potwierdzenie podejrzenia u 6 pacjentów, u których elektrokardiogram powierzchniowy sugerował AVD (ryc. 2).
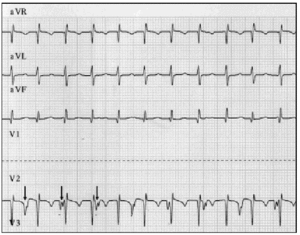
Fig. 2. Śledzenie elektrokardiograficzne przewodów JET, w tym przewodów aVR, aVL i aVF. Dolne śledzenie pokazuje elektrogram przedsionkowy i otrzymano je przez połączenie przewodu zwykle używanego do elektrody V2 z atrialną elektrodą epikardialną. To śledzenie pokazuje zwiększoną aktywność przedsionków (strzałki); dysocjacja przedsionkowo-komorowa wynika z wolniejszej szybkości przedsionków w porównaniu z szybkością komór.
leczenie hipotermii opiera się na obserwacji, że obniżona temperatura Centralna zmniejsza automatyzację komórek rozrusznika serca. Ponieważ pierwszy raport z tego leczenia został opublikowany przez Bash et al., w 1987 roku pojawiły się 3 rozproszone doniesienia o udanym zastosowaniu hipotermii u niewielkiej liczby pacjentów.9,10 celem tych interwencji było osiągnięcie temperatury centralnej 32-35 °C. Naszym celem było zmniejszenie HR do czasu, aż odpowiednie leczenie stymulatorem będzie możliwe, a tym samym uniknięcie głębokiej hipotermii i jej możliwych skutków ubocznych. U 2 pacjentów nie stosowano rozruszników serca, ponieważ nie były dostępne atrialne elektrody epikardialne. Ze względu na ich dobry przebieg kliniczny zdecydowaliśmy się nie stosować elektrody przełykowej. Ze względu na nasz projekt badań nie można było ocenić względnej przydatności digoksyny i amiodaronu podawanego podczas hipotermii w kontrolowaniu HR.
w tej serii pacjentów hipotermia związana ze stosowaniem rozrusznika serca była skuteczną, bezpieczną opcją. Zmiany hemodynamiczne wystąpiły w ciągu kilku godzin i nie zaobserwowano żadnych skutków ubocznych bezpośrednio związanych z hipotermią. Chociaż niewielka liczba badanych przez nas pacjentów nie pozwala na uogólnienie, śmiertelność w naszej serii 8,3% była wyraźnie niższa niż 40% W przypadku leczenia zachowawczego.1 zmarłe niemowlę było jednym z pierwszych pacjentów w serii i miało bardzo szybką tachykardię, która mogła być przyczyną niepowodzenia hipotermii.
regenerację rozpoczęto po co najmniej 36 godzinach stabilności hemodynamicznej bez oczekiwania na przywrócenie stabilnego rytmu zatokowego. Prawdopodobieństwo konieczności ponownego chłodzenia (27%) nie było związane z rytmem zatokowym lub strumieniem, dlatego uważamy, że ponowne chłodzenie może być ustalane w czasie wyłącznie na podstawie kryteriów hemodynamicznych.
ograniczenia naszego badania są związane z każdą retrospektywną analizą obserwacyjną opartą na niewielkiej liczbie pacjentów bez grupy kontrolnej. Niemniej jednak wierzymy, że nasze wyniki, wraz z innymi opublikowanymi raportami, wspierają wykorzystanie hipotermii jako skutecznego i bezpiecznego leczenia w leczeniu JET pooperacyjnego.