| författare | tillhörighet |
|---|---|
| Lindsay A. Weiner, MD | University of Maryland Medical Center, Baltimore, Maryland |
| George Willis, MD | University of Maryland School of Medicine, Institutionen för akutmedicin, Baltimore, Maryland |
| Zachary D. W. Dezman, MD, MS, MS | University of Maryland School of Medicine, Institutionen för akutmedicin, Baltimore, Maryland |
| Laura J. Bontempo, MD, med | University of Maryland School of Medicine, Institutionen för akutmedicin, Baltimore, Maryland |
Fallpresentation
Falldiskussion
Fallresultat
bosatt diskussion
slutlig diagnos
viktiga undervisningspunkter
FALLPRESENTATION
en 52-årig kvinna kom till akutavdelningen (ED) för hemodialys (HD) på grund av njursjukdom i slutstadiet (ESRD). Hon hade tillbringat de föregående flera veckorna på ett sjukhus utanför som behandlades för lunginflammation och bakteremi med daptomycin. Hon lämnade därefter mot medicinsk rådgivning (AMA) efter att ha tagit bort dialysåtkomstkatetern. Hon presenterade för vår ED eftersom hon behövde HD vaskulär åtkomstplacering och återinsättning av dialysbehandlingar. Hennes medicinska historia inkluderade kronisk njursjukdom sekundär till hypertensiv nefroskleros, anemi, hypertoni, djupa venösa tromboser (DVT), systemisk lupus erythematosus och en anfallsstörning av okänd etiologi.
patienten, ett Jehovas Vittne, vägrade blodtransfusioner; därför behandlades hennes anemi med intravenös (IV) administrering av järn, epoetin alfa och folat. Andra läkemedel inkluderade nifedipin, klonidin, metoprolol, sevelamer och prednison. Hon var allergisk mot amoxicillin, azitromycin, hydralazin, labetolol, linezolid, morfin och vankomycin. Hon rapporterade tidigare IV heroinanvändning många år tidigare och tidigare cigarettrökning. Hon förnekade alkoholanvändning eller någon aktuell drog-eller tobaksbruk.
vid ankomsten var hon vaken och i ingen akut nöd med feber på 38.3 msk Celsius, hjärtfrekvens på 87 slag per minut (bpm), blodtryck på 110/65 millimeter kvicksilver (mmHg), andningsfrekvens på 17 andetag per minut och pulsoximetri på 99% medan du andas rumsluft. Hon vägde 80 kilo och var 5 fötter 6 tum lång. Hennes huvud var normocephalic och atraumatisk med fuktiga slemhinnor. Eleverna var anikteriska, lika, runda och reaktiva mot ljus och boende. Nacken var smidig och utan lymfadenopati eller ömhet. Hennes lungor hade grova andningsljud med milda bibasilar sprakar men inga wheezes eller rhonchi. Det fanns inga retraktioner eller ökat andningsarbete. Hennes hjärta var av regelbunden takt och rytm utan murmurs, gnuggar eller galoppar. Hennes buk var mjuk med normala tarmljud och utan distans, ömhet, rebound eller bevakning. Det fanns ingen costovertebral vinkel ömhet. De nedre extremiteterna hade 1 + pittingödem, 2 + dorsalis pedis pulser och var utan ömhet eller deformitet. Patienten hade normal styrka och muskelton i alla extremiteter med intakt känsla. Gamla fistlar var närvarande i vänster och höger övre extremiteter utan påtagliga spänningar. Hon var vaken och orienterad mot person, plats och tid.
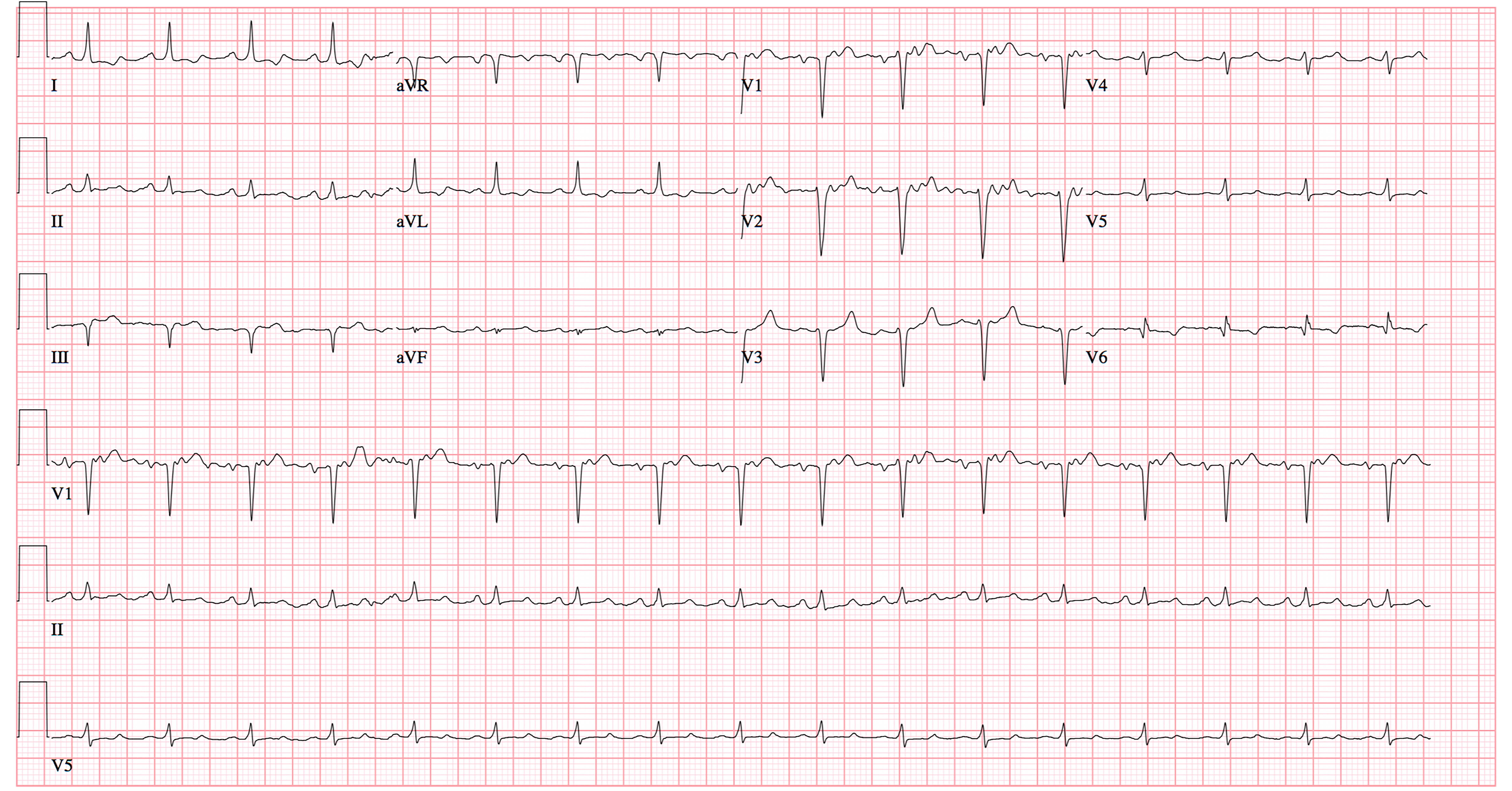
patientens initiala laboratorievärden visas i Tabell 1. Dessa var signifikanta för en liten leukocytos, anemi till 5,3 g/dL, trombocytopeni, hyperkalemi och en förhöjd kreatinin på 11,9 mg/dL. Hennes initiala elektrokardiogram (EKG) visade en sinus takykardi med t-våginversioner i ledningar I och V6 (Bild 1). Detta var oförändrat från ett tidigare EKG. Patienten togs in i medicinteamet och startades på daptomycin. I väntan på sängplacering infördes en icke-tunnelerad vänster femoral dialyskateter av medical intensive care unit (ICU) fellow för initiering av HD. Placeringen bekräftades av den lätta nackdelen med blod från alla hamnar. Under samtyckesprocessen för kateterplacering dokumenterades att patienten uppgav att hon ” hellre skulle dö än att få blodtransfusioner.”Efter kateterplacering gjordes ett försök att starta HS, men hon blev hypotensiv och klagade över svaghet nästan omedelbart. Hennes vitala tecken under det första HD-försöket var ett blodtryck på 85/56 mmHg med en hjärtfrekvens på 105 bpm.
| värden | |
|---|---|
| komplett blodcellsantal | |
| antal vita blodkroppar | 12,4 K / mcl |
| Hemoglobin | 5, 3 g / dL |
| hematokrit | 15.8% |
| Platelets | 133 K/mcl |
| Basic metabolic panel | |
| Sodium | 135 mmol/L |
| Potassium | 5.8 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 27 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 189 mg/dL |
| Calcium | 7.2 mg / dL |
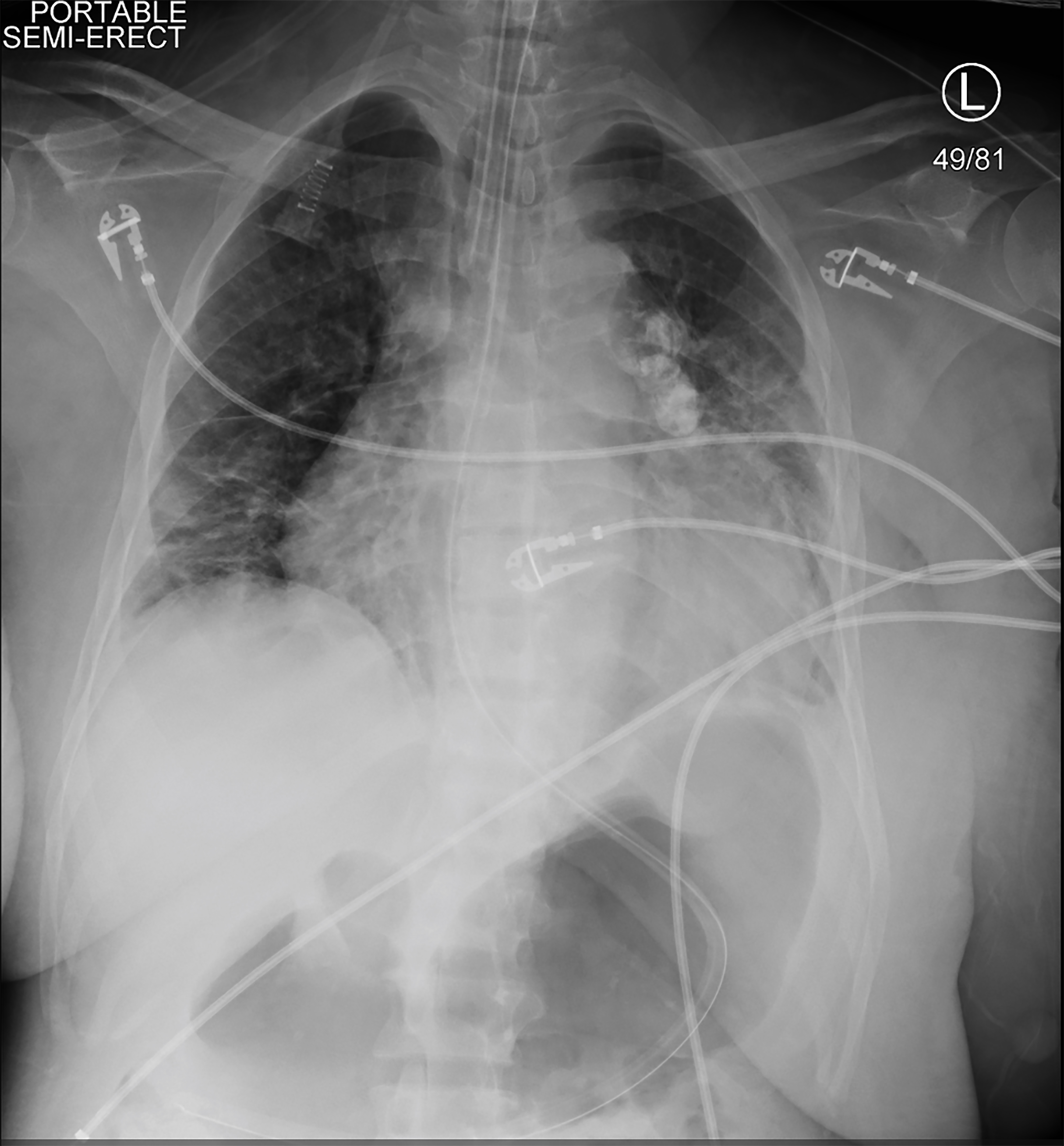
eftersom patienten var symptomatisk och hypotensiv Under HD, inleddes kontinuerlig njurersättningsterapi (CRRT). Kort därefter blev hon hypotensiv, svarade inte och fick ett toniskt kloniskt anfall. Vitala tecken vid den tiden var en hjärtfrekvens på 113 bpm, blodtryck 75/48 mmHg, andningsfrekvens på 20 andetag per minut och syremättnad på 78% i rumsluft. En kort, upprepad fysisk undersökning visade att patienten inte svarade på smärtsamma stimuli och hennes elever var lika och reaktiva. Hon fick 4 mg lorazepam och intuberades för luftvägsskydd. En höger arteriell femoral linje och en höger femoral trippel lumen venös central linje placerades. En röntgenbild på bröstet bekräftade placeringen av endotrakealtuben (bild 2). CRRT stoppades men patienten förblev i chock trots bolusinfusioner av kristalloid, så vasopressorer startades. Hon fick eskalerande doser av vasopressorer när upprepade laboratorievärden indikerade ett hemoglobin på 1,6 g/dL (Tabell 2).
| Values (prior value) | |
|---|---|
| Complete blood cell count | |
| White blood cell count | 13.4 K/mcl (12.4 K/mcl) |
| Hemoglobin | 1.6 g/dL (5.3 g/dL) |
| Hematocrit | 5.7% (15.8%) |
| Platelets | 167 K/mcl (133K/mcl) |
| Complete metabolic panel | |
| Sodium | 131 mmol/L |
| Potassium | 6.7 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 14 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 169 mg/dL |
| Alanine aminotransferase | 23 u/L |
| Aspartate aminotransferase | 31 u/L |
| Alkaline phosphatase | 145 u/L |
| Total bilirubin | 0.4 mg / dL |
| totalt protein | 5, 8 g / dL |
| Albumin | 3, 2 g / dL |
| laktat | 15 u / L |
| arteriell blodgas | |
| pH | 7.23 |
| PCO2 | 28 mmHg |
| PO2 | 214 mmHg |
kort därefter gick hon in i hjärtstillestånd med en rytm av pulslös elektrisk aktivitet (PEA). Återgång av spontan cirkulation uppnåddes efter sex minuters kardiopulmonell återupplivning. Ökad abdominal distans noterades under återupplivningen; därför infördes en tryckavkännande urinkateter. Hennes högsta luftvägs – och blåstryck mättes vid större än 60 cmH2O respektive 50 mmHg. Kirurgi konsulterades sedan. Ett massivt transfusionsprotokoll initierades efter att hennes närmaste släkting gick med på att tillåta transfusion av blodprodukter. En fokuserad bedömning med sonografi för trauma (snabb) utfördes och visade fri vätska i Morrisons påse. När återupplivande åtgärder fortsatte erhölls en ytterligare studie och en diagnos gjordes.
CASE diskussion
detta fall presenteras med en unik och kretsloppssekvens av händelser som Spiral mycket snabbt i en olycklig riktning. När presenteras med patienter som har vaga eller minimala klagomål, Det åligger leverantörer att söka efter ledtrådar för att hjälpa till att ställa diagnosen. Därför började jag med att söka efter ledtrådarna i det här fallet.
patienten presenterade ett huvudklagomål om att behöva dialys. Hon hade nyligen blivit antagen vid en annan anläggning för lunginflammation och bakteremi och fick sin HD-kateter borttagen på grund av misstanke om sepsis. Hon skrev ut AMA från denna anläggning efter att ha fått daptomycin. Det är okänt hur länge hon hade varit utan HD eller om hon avslutade sin antibiotikakurs innan hon lämnade. Men hon är väsentligen asymptomatisk.
hennes tidigare medicinska historia är anmärkningsvärd för anfall samt DVT och anemi. Det finns inget omnämnande av några antikoagulerande eller antiepileptiska läkemedel, vilket indikerar att hon antingen inte kom ihåg namnen på sina mediciner eller att hon inte tog några. Observera att hon är ett Jehovas Vittne och fick därför alternativa terapier för sin anemi, inklusive järn, folat och epogen.
hennes fysiska undersökning avslöjar att hon är febril men med annars stabila vitala tecken. Jag förväntar mig detta med tanke på att hon hade lämnat den andra anläggningen och sannolikt inte avslutat sin antibiotikakurs för hennes lunginflammation och bakteriemi. Andra möjligheter inkluderar en infektion som är resistent mot antibiotikumet eller en nyförvärvad nosokomial infektion från hennes tidigare sjukhusvistelse. Hon har några grova andningsljud och bibasilar knastrar på hennes lungprov, vilket bekräftar hennes lunginflammationshistoria. Lunginflammation är troligen källan till hennes feber såväl som bakteriemi, som kanske inte uppvisar symtom.
hennes laboratoriestudier avslöjade några relevanta resultat. Hon var anemisk såväl som Hyperkalemisk. Hon var också hypokalcemisk och hyperfosfatemisk. Hon hade också lite mild uremi. De flesta av dessa fynd skulle förväntas något hos en ESRD-patient. Anemin kan vara resultatet av njursjukdom. Andra möjligheter till differentialdiagnos för anemi inkluderar blödning, järnbrist och folatbrist. Hon klagar inte på någon blodförlust och vi har inte heller de röda blodkroppsindexen som den genomsnittliga korpuskulära volymen för att kunna göra dessa alternativa diagnoser vid denna tidpunkt. Hennes hyperkalemi beror troligen på hennes brist på HD. Hennes hyperfosfatemi är också sannolikt från brist på HD; dock kan daptomycin också orsaka hyperfosfatemi.
medan hon väntar på sängplacering har hon HD börjat under vilken hon börjar klaga på att känna sig svag och noteras att bli hypotensiv och takykardisk. Hon har sedan CRRT initierat och förblir hypotensiv, blir hypoxisk, svarar inte och har ett tonisk-kloniskt anfall som kräver intubation och vasopressorinitiering. Examen visar lika och reaktiva elever i en patient som inte svarar på smärtsamma stimuli. Laboratoriestudier avslöjar en djupt förvärrad anemi, förvärrad hyperkalemi och intervallutveckling av en mjölksyraacidos. Hon går sedan in i en ärtstopp och, efter framgångsrik återkomst av spontan cirkulation, har blodtransfusion. Men hon är fortfarande hypotensiv och hypoxisk trots intubation. Hon har också en utspänd buk och topp luftvägstryck större än 60 cmH2O. en snabb undersökning avslöjar fri vätska i Morrisons påse.
en sådan djupgående statusförändring efter en terapeutisk intervention kräver allvarlig tanke. Låt oss börja med hypotension och takykardi under HD och efterföljande CRRT. Hypotension under HD är säkert möjlig med högre flödeshastigheter. CRRT har dock mycket långsammare flödeshastigheter och hypotension är mindre frekvent när CRRT används. Så varför är den här personen i chock som kräver vasopressorer efter initiering av HS?
när man närmar sig patienter med chock, kommer den mnemoniska chocken (septisk/spinal; hypovolemisk; obstruktiv; kardiogen; anafylaktisk – K som i mjölk) att tänka på. Sepsis är verkligen möjligt, med tanke på hennes historia av bakteriemi. Det är emellertid mindre troligt att det är orsaken till en sådan djup dekompensation, särskilt med en akut inbrott i inställningen att initiera HD. Hypovolemisk eller hemorragisk chock är en annan möjlighet. Hon har riskfaktorer för både som hon kan vara på antikoagulation med sin historia av DVT,samt eventuellt ha uremiskt trombocyt fel. Detta kommer att behöva undersökas ytterligare. Obstruktiv chock som vid lungemboli eller tamponad är en annan möjlighet. Hon har verkligen riskfaktorer för detta med sin historia av DVT och okänd antikoagulationsstatus. Hon är också hypoxisk, vilket inte förklaras av lunginflammation eftersom hennes ursprungliga mättnader var över 95%. Hon kunde också ha utvecklat tamponad från uremisk perikardit, även om detta är mindre troligt med tanke på att hennes blodureakväve (BUN) inte är signifikant förhöjd och hon hade inga klagomål om perikardit symptom. En annan möjlig orsak till hemodynamisk kollaps som leder till obstruktiv chock är en luftemboli från den nya HD-katetern och efterföljande initiering av HD genom den. Eftersom detta är möjligt måste vi också reta ut det här lite mer.
kardiogen chock är mindre sannolikt eftersom hon sannolikt inte har utvecklat ett smärtfritt hjärtinfarkt så allvarligt att hon gick in i kardiogen chock. Anafylaktiska och endokrina problem är andra möjliga orsaker till chock. Det fanns emellertid inga mediciner som administrerades eller något omnämnande av utslag eller luftvägskompromiss för att föreslå anafylaxi som orsak. Endokrin chock bör övervägas eftersom hon är på prednison, vilket gör binjurinsufficiens en möjlig orsak. Hyperkalemi och hyponatremi som du kan förvänta dig med binjurinsufficiens är närvarande; det finns dock inget omnämnande av bristande efterlevnad eller kräkningar av steroiderna, vilket gör denna möjlighet mindre sannolikt.
beslag under HD är en annan enhet som finns i detta fall. Hon har en historia av anfall, och ingen antiepileptisk finns på hennes medicineringslista. Så, hennes anfall kan säkert vara från bristande efterlevnad. Uremisk encefalopati kan förekomma som anfall när som helst; bullen är dock bara något förhöjd, vilket gör detta osannolikt. Dialys disequilibrium syndrom är en annan orsak till anfall under HD. Det inträffar emellertid vanligtvis under den allra första HD-sessionen och är förknippad med en snabb minskning av BUN. Denna patient har varit på HD under en tid och bullen är inte markant förhöjd, vilket gör denna diagnos osannolik. Slutligen kan minskad perfusion till hjärnan från hypotoni under HD inducera anfall. Patienten blev hypotensiv Under HD, vilket kan hända på grund av högre flödeshastigheter. Hon placerades sedan på CRRT, som använder en långsammare flödeshastighet och har en mycket lägre förekomst av hypotoni; dock blev hon mer hypotensiv. Detta tyder på att det sannolikt finns någon annan orsak till hypotoni snarare än bara HD.
hon har också fri vätska på sin snabba undersökning och har nu en utbredd buk. Tillsammans med den djupt förvärrade anemin måste jag anta att hon blöder i buken. Det finns inget annat än blödning och hemolys som kan förklara en sådan djup nedgång i hennes hemoglobin, och det finns inga bevis för att vara misstänksam mot hemolys i hennes historia, fysisk undersökning eller hjälpstudier.
patienten upplever också förhöjda luftvägstryck på ventilatorn. Det finns flera anledningar till att hennes luftvägstryck kan höjas; men i samband med en distenderad buk och hypotoni kommer abdominal compartment syndrome (ACS) i framkant av mina differentiella diagnoser. Därför måste jag anta att detta är en relativt snabb blödning eftersom hon har tappat sitt hemoglobin avsevärt, gått in i ÄRTSTOPP, förbättrats med blodtransfusioner och kräver flera vasopressorer för att upprätthålla sitt blodtryck. Men varför blöder hon i buken? Hon har inte upplevt något trauma i buken om det inte hände under anfallet på sjukhuset; men om detta hade varit fallet skulle jag anta att denna historia skulle ha givits. Hon kunde säkert ha upplevt någon form av aortakatastrof som en bristad abdominal aortaaneurysm, men det skulle vara väldigt konstigt att detta hade hänt under HD.
nu var jag tvungen att ta ett steg tillbaka och se de diagnostiska ledtrådarna som helhet och sätta ihop dessa pusselbitar. Genom att ta hela denna patientpresentation i sikte uppstår ett gemensamt tema i nästan alla aspekter av hennes händelsesekvens. Blödning. Anemi? Blödning. Hennes anemi förvärras? Definitivt blödning. Hypotension? Blödning. Beslag? Hypoperfusion som kommer från hypotoni som kommer från blödning. Hypoxi? Djup anemi, som kommer från blödning. ACS? Blödning. Laktacidos? Hypotension och anemi från blödning.
nu måste vi bara ta reda på var denna blödning kommer ifrån. När patienten först presenterade hon verkade anmärkningsvärt stabil. Hon hade inga klagomål och hennes vitala tecken, förutom hennes feber, var inom normala gränser. Hon hade en HD-kateter placerad utan att nämna komplikationer. Hon börjar HS och hennes blodtryck sjunker, hennes hjärtfrekvens ökar, och hon blir symtomatisk nästan omedelbart. Jag kunde lätt skylla på HS som orsaken; men hennes leverantörer initierar CRRT och hennes hypotoni förvärras, vilket gör HD mindre sannolikt att vara orsaken. Därför har något hänt före inledandet av HD, eftersom hon var stabil fram till HD började. Det enda som hände före inledandet av HD var placeringen av HD-katetern. Det nämns inga komplikationer eller betydande blodförlust under placeringen. Det är dock den enda händelsen mellan att patienten är stabil och instabil.
om det inte fanns något omnämnande av en uppenbar komplikation, vad kunde ha hänt? Kom ihåg att den förmodade källan till blödningen är i buken. HD-katetern placerades i ljumsken, som inte ligger långt från buken och retroperitonealt utrymme. Om leverantören som placerade linjen trängde in på andra sidan av kärlväggen kunde han / hon lätt ha placerat HD-katetern så att dess spets ligger i retroperitoneum. Om så är fallet skulle patienten extravasera blod i retroperitonealutrymmet och orsaka hypotoni, minskad perfusion, laktacidos och djup anemi. När det retroperitoneala utrymmet fylldes upp skulle det öka intra-abdominalt tryck som så småningom leder till ACS. En genomgång av litteraturen avslöjar en fallrapport om denna typ av komplikation.1
därför är den diagnostiska studien jag skulle utföra ett datortomografi (CT) angiogram i buken och bäckenet. Detta skulle visa var HD-katetern placerades och undersöka retroperitoneum för tecken på aktiv blödning.
FALLRESULTAT
den diagnostiska studien var ett CT-angiogram i buken och bäckenet. Den vänstra femorala HD-katetern hade punkterat patientens vänstra gemensamma iliacven och bildat ett högersidigt retroperitonealt hematom. Det kirurgiska teamet bedömde patienten och utförde en temporerande laparotomi vid sängen för att behandla hennes akuta ACS. Detta avslöjade ett stort, högersidigt retroperitonealt hematom och en stor mängd ascites. Patientens hemodynamik stabiliserades efter denna procedur och hon kunde komma av alla vasopressorer. Hon transporterades sedan direkt till operationssalen med kärlkirurgiteamet för en framväxande reparation av hennes vänstra gemensamma iliacven.
hon fortsatte att få flera blodtransfusioner under reparationen. Därefter överfördes hon till den kirurgiska ICU med en öppen buk som därefter reparerades. Patienten vaknade helt neurologiskt intakt och släpptes hem fem veckor efter hennes skada.
RESIDENT diskussion
ACS är slutpunkten för ett spektrum som börjar med intra-abdominal hypertoni (IAH) och slutar när det intra-abdominala trycket överstiger 20 mmHg och åtföljs av slutorgan dysfunktion.2 normalt buktryck, även hos kritiskt sjuka patienter, bör vara < 12 mmHg. IAH, som kan graderas i steg, definieras som ett tryck på 12-25 mmHg utan närvaro av organdysfunktion.
det finns flera olika typer av ACS. Primär ACS förekommer i trauma eller kirurgiska katastrofer som resulterar i en stor hemorragisk händelse, som i det presenterade fallet.3 sekundär ACS uppstår när ICU-patienter återupplivas aggressivt med stora volymer kristalloider.4,5 mindre vanliga sekundära orsaker inkluderar stora, rymdupptagande lesioner, tarm eller retroperitonealt ödem och pankreatit. Sekundär ACS är smygande och diagnostiseras vanligtvis efter en fördröjning, vilket ytterligare komplicerar en redan hög dödlighet.4,5
dödligheten hos ACS beror på komprometterad organperfusion och senare organsvikt. I njurarna leder minskad renal perfusion till trängsel och oliguri, medan ökat facktryck orsakar direkt kompression av organet.6,7 ökat splanchniskt vaskulärt motstånd resulterar i tarmödem, translokation av tarmbakterier, hyperlactemi och sepsis.6,7 Hjärtförspänning kan minskas på grund av kompression av den sämre vena cava som orsakar minskad hjärtutgång, medan höger ventrikulär efterbelastning ökar.7 syresättningen försämras när membranet trycks cephalad och funktionell restkapacitet minskar.7 intrakraniellt tryck stiger också som ett resultat av jugulär venös kompression som försämrar venös återgång. Kliniskt kommer patienten att uppvisa hypotoni, hypoxi, akut njurskada, förändrad mental status, kramper eller svarlöshet; så småningom upplever patienten total kardiovaskulär kollaps.6-8
guldstandarden för diagnos av ACS är mätning av blåstrycket indirekt med en urinkateter.9 för att mäta ett exakt tryck måste patienten vara i ryggläge och mätningen vid utgången, med omvandlaren nollställd och i linje med iliac crest. Denna mätning har visat sig korrelera med direkt uppmätt intra-abdominalt tryck.10 mätning av blåstryck var 4-6 timmar är tillräcklig hos kritiskt sjuka patienter som riskerar att utveckla ACS.
grundpelaren i behandlingen för ACS är dekompressiv laparotomi, vilket vanligtvis kräver att patienten lämnar en öppen buk postoperativt.11 andra sekundära temporära åtgärder inkluderar sedering och analgesi, neuromuskulär förlamning, dekompression av tarminnehållet med ett naso – eller endogastriskt rör, diuretika och CRRT.11,12
dödligheten av ACS förblir hög trots medicinsk intervention. Medan dekompressiv laparotomi effektivt minskar intra-abdominalt tryck, är denna procedur associerad med flera medicinska comorbiditeter med en dödlighet som fortfarande är upp till 50%.13 Detta kan bero på det faktum att patienter vid tidpunkten för dekompressiv laparotomi är kritiskt sjuka och förfarandet anses vara en sista utväg.
en andra viktig fråga för diskussion i detta fall är det etiska dilemma som leverantörerna står inför för denna kritiskt sjuka patient vars religiösa tro var i motsats till standardbehandlingen (blodprodukttransfusion) för hennes sjukdom. Patienten hade inledande dokumentation i sitt diagram över läkare-patientkonversationen under vilken hon uppgav sitt medvetna vägran av blodprodukter. Hon hade dock inte skrivit, undertecknat dokumentation av blodprodukttransfusionsavslag i diagrammet. Medan patienten var medvetslös och i extremis, hennes man, som inte är en praktiserande Jehovas Vittne, vänt sitt beslut i ett försök att rädda hennes liv. Var faller detta beslut i balans mellan autonomi vs. kraften hos nästa släkting att bestämma vilka medicinska ingrepp en patient ska få? Vad händer när nästa släkting fattar ett beslut som strider mot patientens val? I livs – eller dödssituationer med etiska dilemman, där snabbt beslutsfattande kommer att avgöra patientens resultat, hur kan denna börda läggas på nära och kära?
det etiska dilemmaet ligger därför i tanken att även om transfusion bryter mot värdet av autonomi, uppfyller det samtidigt det etiska begreppet välgörenhet. I allmänhet bör patientens personliga direktiv ha företräde framför alla beslut som fattas av den medicinska fullmakten. Familjens beslut att överföra på uppdrag av den omedvetna patienten, som det ses i det aktuella fallet, är dock juridiskt lämpligt även om det bryter mot patientens autonomi.
etikutskottet konsulterades efter att patienten redan hade fått en massiv transfusion av blodprodukter och fortsatte att få ytterligare röda blodkroppstransfusioner. Utskottet rekommenderade att patienten inte längre får blodprodukttransfusioner trots närmaste samtycke. Patienten vaknade helt neurologiskt intakt och informerades om blodtransfusionerna. Hon bestämde sig för att hon i framtiden bara skulle acceptera blodbankplasma och familjedonerade röda blodkroppar under en akut händelse. Patienten släpptes hem fem veckor efter hennes iatrogena skada.
slutlig diagnos
Iatrogen vänster vanlig iliac venperforering med resulterande bukfacksyndrom.
viktiga undervisningspunkter
ACS uppstår när det intra-abdominala trycket är över 20 mmHg och ändorganskador är närvarande.
primär ACS orsakas av trauma eller kirurgi, men var uppmärksam på sekundär ACS som ses vid massiv återupplivning, särskilt i ICU.
guldstandarden för ACS-diagnos är ett uppmätt blåstryck.
behandling är en laparotomi samt temporerande åtgärder som evakuering av tarminnehåll och/eller sedering och förlamning.
dokumenterat patientinformerat samtycke och / eller institutionellt Granskningsstyrelsens godkännande har erhållits och lämnats in för offentliggörande av denna fallrapport.
Fotnoter
Sektionsredigerare: Rick A. McPheeters, DO
fulltext tillgänglig via öppen åtkomst på http://escholarship.org/uc/uciem_cpcem
adress för korrespondens: Laura J. Bontempo, MD, med, University of Maryland, Department of Emergency Medicine, 110 S Paca Street, 6th Floor, Suite 200, Baltimore, MD 21201. E-post: [email protected]. 2:103 – 108
Inlämningshistorik: Revision mottagen 22 januari 2018; inlämnad 19 mars 2018; accepterad 21 mars 2018
intressekonflikter: Genom CPC-EM artikel submission agreement, alla författare är skyldiga att avslöja alla anslutningar, finansieringskällor och ekonomiska eller förvaltningsrelationer som kan uppfattas som potentiella källor till partiskhet. Författarna avslöjade ingen.
1. Pafitanis G, Spyridon K, Theodorakopoulou E, et al. En fallrapport om bukfacksyndrom orsakat av felaktig placering av en femoral venös kateter. Int J Surg Fall Rep. 2015; 12: 84-6.
2. Maluso P, Olson J, Sarani B. hypertoni i buken och syndrom i buken. Crit Vård Clin. 2016;32(2):213-22.
3. Morken J, Västra MA. Abdominal facksyndrom i intensivvården. Curr Opin Crit Vård. 2001;7(4):268-74.
4. Biffl WL, Moore EE, Burch JM, et al. Sekundärt bukfacksyndrom är en mycket dödlig händelse. Am J Surg. 2001; 182 (6):645-8.
5. Burrows R, Edington J, Robbs JV. En varg i vargens kläder: bukfackssyndromet. S Afr Med J. 1995; 85 (1): 46-8.
6. Caldwell CB, Ricotta JJ. Förändringar i visceralt blodflöde med förhöjt intraabdominalt tryck. J Surg Res. 1987;43 (1): 14-20.
7. Balogh Z, McKinley BA, Cox CS, et al. Abdominal facksyndrom: orsaken eller effekten av multipel organsvikt efter skada. Chock. 2003;20(6):483-92.
8. Vidal MG, Ruiz Weisser J, Gonzalez F, et al. Incidens och kliniska effekter av intra-abdominal hypertoni hos kritiskt sjuka patienter. Crit Vård Med. 2008;36(6):1823-31.
9. Kron IL, Harman PK, Nolan SP. Mätningen av intra-abdominalt tryck som ett kriterium för återutforskning i buken. Ann Surg. 1984; 199 (1): 28-30.
10. Han är en av de mest populära. Bukfacksyndrom. J Trauma. 1998;45(3):597-609.
11. Han är en av de mest kända i världen. Intra-abdominal hypertension och abdominal compartment syndrome: uppdaterade concensus definitioner och riktlinjer för klinisk praxis från World Society of the Abdominal Compartment Syndrome. Intensivvård Med. 2013;39(7):1190-206.
12. JF, Leppaniemi A, boll CG, et al. Alternativ till formell bukdekompression. Är Surg. 2011; 77(Sl): S51-7.
13. De Waele JJ, Hoste EA, Malbrain ML. Dekompressiv laparotomi för bukfacksyndrom-en kritisk analys. Crit Vård. 2006; 10 (2): R51.