introduktion
den adaptiva strålningen av insekter över olika klimat har underlättats delvis av den upprepade utvecklingen av diapause, en föregripande utvecklingsstopp före ogynnsamma förhållanden (t.ex. vinter, torr säsong; Waterhouse och Norris, 1980; Tauber et al., 1986; Danks, 1987; Hodkova och Hodek, 2004). Diapause initieras vanligtvis som svar på en token miljö cue (t. ex., säsongsförändring i fotoperiod), upprätthålls under en genetiskt bestämd period och avslutas sedan efter att gynnsamma förhållanden har återvänt. Således tillåter diapause insekter att anpassa sin tillväxt och reproduktion med lokala säsongscykler (Tauber et al., 1986; Danks, 1987). Diapause är en nyckelregulator för livshistoria, Geografiskt område och säsongsöverflöd för många insektsbestämare (t.ex. Kemp och Bosch, 2005; Fr Bisexuell et al., 2013), jordbruksskadedjur (t.ex. Pullin et al., 1991; Li et al., 2012; Levine et al., 2015) och sjukdomsvektorer (t.ex. Denlinger och Armbruster, 2014; Gray et al., 2016). Dessutom åberopar diapause utbredda fysiologiska modifieringar inklusive ackumulering av näringsreserver, undertryckande av metabolisk aktivitet, ökad anaerob katabolism, cellcykelstopp, förändringar i Wnt-signalering och uppreglering av olika stresstoleransmekanismer (Denlinger, 2002; Hahn och Denlinger, 2007, 2011; King and MacRae, 2015; Ragland and Keep, 2017). Att förstå de regleringsmekanismer som ligger bakom diapause är ett långvarigt problem i organismbiologi och kommer att underlätta utvecklingen av nya förvaltningsmetoder för nyckelarter.
Ecdysteroider och juvenila hormoner reglerar ett brett spektrum av fysiologiska och utvecklingsprocesser hos insekter (Gruntenko och Rauschenbach, 2008; Jindra et al., 2013; Palli, 2016), inklusive diapause (Denlinger, 1985; Denlinger et al., 2012). Den specifika hormonella signalreglerande diapausen tenderar att variera beroende på det stadium då utvecklingsstopp inträffar (Denlinger et al., 2012). Till exempel, utvecklingsstopp under larv eller pupal diapause regleras vanligtvis av förändringar i ecdysteroid överflöd (t.ex. Ohtaki och Takahashi, 1972; Bowen et al., 1984; Richard et al., 1987). Däremot regleras utvecklingsstopp under vuxen diapause ofta av förändringar i juvenil hormonöverflöd (t.ex. Spielman, 1974; Schooneveld et al., 1977; Saunders et al., 1990 och se recension i Denlinger et al., 2012).
ett stort gap finns i vår förståelse av hormonell reglering av embryonal diapause, som observeras allmänt över Lepidoptera, Orthoptera, Hemiptera och Diptera. Tidigare forskning har omfattande dokumenterat endokrin reglering av embryonal diapause i silkesmask (Bombyx mori) av diapause hormon (Hasegawa, 1963; Yamashita och Hasegawa, 1966; Yamashita, 1996). Denna reglerande roll för diapausehormon verkar emellertid vara unik för B. mori och har därmed gett liten inblick i den hormonella grunden för embryonal diapause hos andra arter (Denlinger et al., 2012). Utöver B. mori har hormonell reglering av embryonal diapause etablerats i bara tre arter. Gypsy moth (Lymantria dispar) genomgår en utvecklingsstopp initierad och underhålls av högre överflöd av ecdysteroids (Lee et al., 1997; Lee och Denlinger, 1997) medan låg ecdysteroid överflöd reglerar diapause i två johannesbröd (Chortoicetes terminifera, Locusta migratoria; Gregg et al., 1987; Tawfik et al., 2002).
hittills har ingen studie karakteriserat hormonöverflöd under embryonal diapause av någon Dipteranart. Här tar vi itu med detta gap genom att undersöka hormonell reglering av embryonal diapause i den asiatiska tigermyggen, Aedes albopictus. Under de senaste 30 åren har denna medicinskt viktiga vektor (Paupy et al., 2009) har framgångsrikt invaderat tempererade regioner över hela världen (Benedict et al., 2007) delvis på grund av en embryonal diapause som har underlättat överlevnad under långväga transporter (Juliano och Lounibos, 2005; Diniz et al., 2017) och utvecklades snabbt för att anpassa tidpunkten för utvecklingsstopp med lokala klimatförhållanden (Urbanski et al., 2012). Tempererade populationer av Ae. albopictus går in i en maternellt reglerad, fotoperiodisk diapause. Under korta, höstliga dagslängder producerar kvinnor ägg som fullbordar embryonal utveckling men förblir eldfasta mot kläckningsstimuli som faratlarver inuti äggets korion fram till nästa vår. Under det senaste decenniet, transkriptionsreglering av embryonal diapause i Ae. albopictus har i stor utsträckning karakteriserats (Urbanski et al., 2010; Poelchau et al., 2011, 2013a, b; Huang X. et al., 2015; Batz et al., 2017) men den hormonella regleringen av denna avgörande anpassning är fortfarande okänd. Vi kvantifierade 20-hydroxyecdysone (20he) och juvenil hormon III (JH3) i diapausing och icke-diapausing ägg vid tre tidpunkter som fäste viktiga stadier av embryonal utveckling och tolkade våra resultat i samband med tidigare insamlad RNAseq (Poelchau et al., 2013a, b) och manipulerande data (Suman et al., 2015).
material och metoder
Äggsamling
alla mätningar använde F11-ägg från en laboratoriekoloni av Ae. albopictus grundades i augusti 2015 från över 200 larver samlade i Manassas, VA, USA. Före detta experiment upprätthölls befolkningen under tidigare beskrivna förhållanden . För att generera äggprover för detta experiment bibehölls F10-larver i 5,5 L Sterlitbehållare med en densitet av cirka 250 larver per 2.5 L avjoniserat (DI) vatten med 5 mL matuppslamning (Armbruster och Conn, 2006) under ld-fotoperiod vid 21 kcal C och 80% RH. Varje måndag–onsdag–fredag filtrerades larverna genom ett finmaskigt nät och överfördes sedan till en ren 5,5 L Sterlitbehållare; puppor distribuerades till vuxna burar som upprätthölls under antingen diapaus-avvärjande ld-fotoperiod eller diapaus-inducerande, kortdagsfotoperiod (SD, 8:16 L:D).
vuxna kvinnor tillhandahölls veckovis blodmjöl och en ovipositionskopp fodrad med oblekt pappershandduk och halvfylld med DI-vatten tills ovipositionen upphörde. Ägg samlades dagligen, hölls på en våt pappershandduk i 48 h, lufttorkades sedan och förvarades i behållare under SD-förhållanden. Vid 5, 7 och 11 dagar efter oviposition (dpov) vägdes uppsamlade ägg till närmaste 1 accug (medelvärde: 11.460 mg, intervall: 9.1-19.5 mg) På en MX5–mikrobalans (Mettler-Toledo, Columbia, OH, USA), placerad i 1.5 mL rör, snäppfryst i flytande kväve mellan 11 AM och 12 pm (Zeitgeber tid 3-4 h) och lagrad vid -80 C. En delmängd av ägg behölls för att bekräfta att ld-och SD-fotoperiodförhållanden stimulerade produktionen av icke-diapause-respektive diapause-ägg (se Urbanski et al., 2012).
vi provade ägg på 5, 7 och 11 dpov av två skäl. Först, Ae. albopictus initierar diapause (sensu Ko Occurt Occl, 2006; Ko Occurt Occl et al., 2017) efter avslutad embryonal utveckling (Mori et al., 1981). Under de förhållanden som används i våra experiment, Ae. albopictus embryon genomgår segmentering vid ungefär vid 5 dpov och icke-diapause embryon är behöriga att kläcka vid ungefär 7 dpov (Poelchau et al., 2013a). Av 11 dpov är utvecklingsstopp fast etablerad i diapause embryon (Poelchau et al., 2013b). Således valde vi att jämföra diapause och icke-diapause embryon vid tidpunkter som bracketing perioden med kläckningskompetens, inklusive etablering av utvecklingsstopp under diapause. För det andra valde vi tidpunkter som liknade de som användes för tidigare RNAseq-experiment av embryon (Poelchau et al., 2013a, b) så att dessa data kan utnyttjas för att tolka våra nuvarande resultat. Dessa RNAseq-resultat befanns tidigare vara väl korrelerade med genuttrycksresultat erhållna via qRT-PCR (Poelchau et al., 2013a).
Ecdysteroidkvantifiering
för att extrahera ecdysteroider placerades äggprover i ett borosilikatglas 0,5 mL koniskt bottenmikrovävnadssliprör (Wheaton, Millville, NJ, USA) med 1 kg farnesol (Sigma-Aldrich, St.Louis, MO, USA) tillsatt som en intern standard. Ägg homogeniserades manuellt tre gånger med en Teflonpestel i 300 oc HPLC-klass kyld MeOH snurrade sedan vid 12 000 RCF i 10 minuter i en kyld (4 oc C) centrifug. Den resulterande supernatanten poolades och eluerades sedan genom aluminiumoxidkolonner två gånger med kyld 90% MeOH och en gång med MeOH. Proverna torkades ner i en kyld (4 kg c) vakuumcentrifug, resuspenderades i 20 kg MeOH och lagrades vid -80 kg C tills analys. Positiva kontroller framställdes genom tillsats av 1 occurg vardera av 20HE (Sigma-Aldrich) och farnesol till tomma rör som annars bearbetades identiskt. Provanalys av ecdysteroid koncentration utfördes med användning av en Micromass Quattro Micro LC-MS / MS (Waters Co., Milford, MA, Förenta Staterna). Injektionsvolymerna var 5,0 occl, med separationer utförda med hjälp av ACQUITY UPLC BEH C18 2,1 mm med 50 mm kolumner med en 1,7 occlm stationär fas (Waters Co.). Driftsförhållandena för LC-körningar var en mobil fasflödeshastighet på 0,37 mL min – 1 med en binär mobil fas på 0,1% myrsyra i acetonitril och 0,1% myrsyra i vatten. Initiala förhållanden var 1:99 acetonitril: vatten, följt av isokratiskt flöde i 0,3 min. Vid 0,3 min, en linjär gradient från 1:99 till 99:1 acetonitril:vatten applicerades över 4,2 min, följt av 1,0 min isokratiskt flöde vid 99:1 acetonitril:vatten, varefter mobilfasen återvände till 1:99 acetonitril:vatten. Masspektrometerinställningarna var elektrospraypositiva, med en desolvationstemperatur på 350 C. 20he och farnesol eluerad vid 2,89 respektive 4,97 min och kvantifierades med användning av multipel reaktionsövervakning av karakteristiska övergångar: 481,22 (m/z) > 445,24 (m/z) respektive 205,41 (m/z) > 121,09 (m/z). Detektionsgränsen för analysen är ungefär 5 pg.
kvantifiering av Juvenilhormon
varje äggprov placerades i ett borosilikatglas 0,5 mL konisk botten mikrovävnadssliparrör (Wheaton) med 1 kg farnesol (Sigma-Aldrich) tillsatt som en intern standard. Ägg homogeniserades manuellt tre gånger med en Teflon-pestel i 500 oc HPLC-klass kyld hexan och Spanns sedan vid 12 000 RCF i 10 minuter i en kyld (4 oc C) centrifug. Hexanfraktionerna rekombinerades i en ren borosilikatglasflaska och torkades genom vakuumcentrifugering. JH kvantifierades med användning av gaskromatografi / masspektrometri som tidigare beskrivits (Brent och Vargo, 2003). Kortfattat tvättades återstoden ur flaskorna med tre sköljningar av hexan och tillsattes till borosilikatglaskolonner fyllda med aluminiumoxid. För att filtrera bort föroreningar eluerades prover genom kolumnerna successivt med hexan, 10% etyleterhexan och 30% etyleterhexan. Efter torkning derivatiserades proverna genom upphettning vid 60 kcal C i 20 minuter i en lösning av metyl-D-alkohol (Sigma-Aldrich) och trifluorättiksyra (Sigma-Aldrich). Prover torkades ner, resuspenderades i hexan och eluerades igen genom aluminiumoxidkolonner. Icke-derivatiserade komponenter avlägsnades med 30% etyleter. JH-derivatet uppsamlades i nya flaskor genom tillsats av 50% etylacetat-hexan. Efter torkning återsuspenderades proverna i hexan och analyserades sedan med användning av en HP 7890A-serie GC (Agilent Technologies, Santa Clara, CA, USA) utrustad med en 30 m 0,25 mm zebron zebron ZB-vaxkolonn (Phenomenex, Torrance, CA, USA) kopplad till en HP 5975c inert mass selektiv detektor. Helium användes som bärargas. JH form bekräftades genom första kör testprover i skanningsläge för kända signaturer av JH 0, JH i, JH II, JH3, och JH3 etyl; JH3 bekräftades som den primära endogena formen i denna art. Efterföljande prover analyserades med MS SIM-läge, övervakning vid m / z 76 och 225 för att säkerställa specificitet för D3-metoxihydrinderivatet av JH3. Total överflöd kvantifierades mot en standardkurva av derivatiserad JH3 och justerades för äggens startmassa. Detektionsgränsen för analysen är ungefär 1 pg.
statistiska analyser
analyser utfördes i R (R Core Team, 2019). Jh3-överflöd log-transformerades och analyserades med ANOVA för att testa för effekter av diapause status, ålder och deras interaktion. 20HAN överflöd var icke-linjär och passar med två polynom regressionsmodeller: en fullständig modell inklusive ålder och utvecklingsstatus (diapause, non-diapause) och en reducerad modell som endast innehåller ålder. Modeller jämfördes med ANOVA för att avgöra om inklusive utvecklingsstatus förbättrade förklarande kraft avsevärt.
Transkriptionsanalyser utnyttjade tidigare insamlade RNAseq-data från diapause och icke-diapause Ae. albopictus ägg (kompletterande Dataset 1; Poelchau et al., 2013a, b). Differentiellt uttryckta gener vid 3, 6 och 11 dpov undersöktes genom genuppsättningsanrikningsanalyser (Mootha et al., 2003) med hjälp av Pianopaketet (V Askorbremo et al., 2013) inställd på standardparametrar följt av FDR-korrigering. En referensgenuppsättning annoterades med den biologiska processen GO-termer tilldelade på Vektorbas (Giraldo-Calder Accord et al., 2015). Jh3-och ecdysteroid-syntesväggener såväl som JH3-receptorer och nedbrytningsgener annoterades manuellt enligt tidigare litteratur (Bai et al., 2007; Li et al., 2011; Nouzova et al., 2011; Niwa och Niwa, 2014; Matthews et al., 2016). Dessutom kommenterade Vi jh3-och ecdysteroidinducerbara gener baserade på genbeskrivningar som tillhandahålls i Vektorbas (Giraldo-Calder Askorbn et al., 2015). En fullständig översikt över dessa genuppsättningar tillhandahålls i kompletterande Dataset 1.
resultat
Genomsnittlig diapausincidens var 95,9% (intervall: 90,5–100%) under SD fotoperiod och 5.4% (intervall: 1,8–9,5%) under ld fotoperiod (kompletterande Dataset 2); således inducerade våra fotoperiodiska behandlingar de förväntade diapause-svaren. 20HAN nådde en topp under både diapause-och icke-diapause-förhållanden vid 7 dpov men inklusive diapause-status som en faktor i en kvadratisk modell för 20han överflöd förbättrade inte modellens förklarande kraft (Figur 1a och kompletterande Dataset 3; F3,43 = 0.21, p = 0.890). Dessa resultat indikerar att diapausstatus inte signifikant förklarar variation i 20he titer. Väganalys av RNAseq indikerade att varken 20he-syntesvägen eller de 20he-inducerbara generna förändrades signifikant under diapause vs icke-diapause-förhållanden vid 3, 6 eller 11 dpov (Tabell 1).

Tabell 1. Analysresultat för anrikning av genuppsättningar, se kompletterande Dataset 1 för en fullständig sammanfattning av dessa genuppsättningar.
JH3 bekräftades vara den primära formen av juvenil hormon i denna art. Jh3-överflöd reducerades signifikant i diapause-embryon (Figur 1b och kompletterande Dataset 3; F1,64 = 5.08, p = 0.028). Ålder (F2,64 = 0, 66,p = 0, 518) och interaktionen mellan diapausstatus och ålder (F2, 64 = 0, 13, p = 0, 883) påverkade emellertid inte JH3-nivåer. Väganalys av RNAseq-data indikerade att jh3-syntesvägen undertrycktes signifikant vid 3 dpov och JH-inducerbara gener undertrycktes signifikant vid 6 dpov (Figur 2 och Tabell 1).
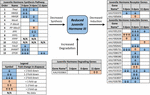
Figur 2. Sammanfattning av differentiellt uttryck av gener som är involverade i jh3-syntes, nedbrytning och induktion för Ae. albopictus (Poelchau et al., 2013a, b). Betydande diapausinducerade minskningar (blå) eller ökningar (orange) indikeras av skuggade celler. Differentialstorleken indikeras med pilar som beskrivs i legenden längst ner till vänster. Gener utan vanliga namn identifieras med Vektorbas-ID-nummer.
diskussion
Diapause är en utbredd anpassning som gör att insekter kan anpassa sin tillväxt och reproduktion med säsongsbetonade gynnsamma förhållanden (Tauber et al., 1986; Danks, 1987). Att förstå de hormonella förändringarna genom vilka insekter samordnar uppfattningen av externa, diapause-inducerande signaler med de fysiologiska mekanismerna som leder till utvecklingsstopp är ett långvarigt mål i biologi (Lees, 1956; Denlinger, 2002). Årtionden av forskning har lett till identifiering av vanliga hormonella strategier för diapause vid larv -, pupal-och vuxenstadier; emellertid är den hormonella regleringen av embryonal diapause i stort sett okänd, särskilt i Diptera (Denlinger, 1985, 2002; Denlinger et al., 2012). I denna studie bekräftas vår direkta mätning av minskat jh3-överflöd i diapause av tidigare profilering av genuttryck (Poelchau et al., 2013a, b) och manipulativa experiment (Suman et al., 2015) stöder hypotesen att JH3 reglerar embryonal diapause i denna art.
Ecdysteroids
i den aktuella studien mätte vi direkt ecdysteroidöverflöd vid tre tidpunkter under diapause och icke-diapause förhållanden i embryon av mygga Ae. albopictus. I överensstämmelse med tidigare resultat från Toxorhynchites amboinensis (Russo och Westbrook, 1986) nådde 20he-nivåerna nära slutet av embryonal utveckling (7 dpov; Figur 1a). Men 20he titer skilde sig inte signifikant mellan diapause och icke-diapause ägg. Vidare genomgick varken 20he-syntesvägen eller 20he-inducerbara gener några signifikanta, samordnade förändringar i genuttryck (Tabell 1). Vi drar slutsatsen att, i motsats till tidigare undersökta embryonala diapaus i Lepidoptera och Orthoptera (Hasegawa, 1963; Yamashita och Hasegawa, 1966; Gregg et al., 1987; Yamashita, 1996; Lee och Denlinger, 1997; Lee et al., 1997; Tawfik et al., 2002), 20han reglerar inte initiering av diapause i Ae. albopictus.
Juvenil hormon
däremot observerade vi ungefär dubbelt lägre jh3 överflöd i diapause embryon (Figur 1b). Medan mindre i storlek än skillnader i jh3 överflöd detekteras under diapause vs. icke-diapause förhållanden i insekter som diapause vid andra livsstadier (t.ex. Yin och Chippendale, 1979; Walker och Denlinger, 1980; Readio et al., 1999) bekräftas våra direkta mätningar av transkriptionsbevis (Figur 2). Till exempel undertrycks jh3-syntesvägen signifikant under tidig diapausberedning (3 dpov). Stödja vår tolkning av dessa resultat har tidigare studier funnit att minskat uttryck av gener längs jh3-syntesvägen är starkt korrelerat med lägre jh3-överflöd i båda Aedes aegypti (Nouzova et al., 2011; Rivera-Perez et al., 2014) och Diploptera punctata (Huang J. et al., 2015). JH-inducerbara gener undertrycks också signifikant under sen diapausberedning (6 dpov; Tabell 1), vilket tyder på att diapaus-avsedda embryon har en begränsad kapacitet att svara på JH3-signalering nära den tid som icke-diapausembryon blir kompetenta att kläcka. Vidare är genuttryck för ett JH3-nedbrytande enzym (JH-esteras) signifikant uppreglerat i tidigt diapausunderhåll (11 Dpov; Figur 2) såväl som senare i diapausunderhåll (21 och 40 dpov; Poelchau et al., 2013b) tyder på att JH3 kan förbli vid låg överflöd i hela diapausen i denna art.
minskat jh3-överflöd under utvecklingsstopp är något kontraintuitivt eftersom låg juvenil hormontiter typiskt är associerad med progressiva Molter, särskilt från larv till pupalstadium (Palli, 2016). Tillämpning av en jh3-analog (pyriproxyfen) till diapause Ae. albopictus ägg accelererar hastigheten för diapause-uppsägning på ett dosberoende sätt (Suman et al., 2015). Vid den mest effektiva dosen avslutar cirka 80% av pyriproxyfen-exponerade ägg diapause med 30 dpov jämfört med bara 1% diapause-uppsägning med 80 dpov för kontrollägg (Suman et al., 2015). Förändringar i jh3-överflöd kan också generera en embryonal diapause – liknande fenotyp i andra arter. Till exempel I B. mori, experimentell reduktion av jh3-syntes genom JHAMT knockout resulterar i fullt utvecklade faratlarver som inte svarar på kläckningsstimuli; denna fenotyp kan räddas på ett dosberoende sätt genom applicering av antingen extraherad JH3 eller metopren, en jh3-analog (Nakao et al., 2015). På samma sätt producerar experimentell tillskott av en annan juvenil hormonanalog (RO-20-3600) till nyligen deponerade Drosophila melanogaster ägg faratlarver som är mobila I ägget men misslyckas med att kläcka (Smith och Arking, 1975). Tillsammans indikerar dessa data att juvenilhormonöverflöd sannolikt bidrar till reglering av kläckningssvar i olika insekter. Embryonal diapause vid farate larvstadiet definieras av ett misslyckande att svara på kläckningsstimuli således kan förändringar i av juvenil hormonöverflöd representera en vanlig hormonell strategi för att reglera denna form av diapause.
i samförstånd med tidigare transkriptionella och manipulerande data implicerar våra resultat starkt minskat jh3-överflöd som den troliga regulatorn för embryonal diapause i Ae. albopictus. Denna forskning är den första direkta kvantifieringen av hormonöverflöd under embryonal diapause i alla Dipteranarter och representerar ett viktigt steg mot att klargöra hormonell reglering av denna avgörande anpassning till ogynnsamma miljöer. Att karakterisera kopplingen mellan yttre stimuli och utvecklingsstopp via hormonell signalering är fortfarande en stor utmaning (Denlinger, 1985; Denlinger et al., 2012). Att belysa dessa vägar i en mängd olika arter kommer att ge kritisk insikt för grundläggande och tillämpade problem, inklusive att förstå den molekylära och fysiologiska grunden för livshistoriens utveckling, förutsäga arters svar på klimatförändringar och identifiera nya mål för hantering av skadedjur och vektorarter (Denlinger, 2008).
datatillgänglighet uttalande
alla dataset som genereras för denna studie ingår i artikeln/kompletterande Material.
Författarbidrag
ZB, CB och PA bidrog till uppfattningen, utformningen av studien och förberedde det första utkastet till manuskriptet. ZB, MM och JS utförde djurhållningen och samlade äggproverna. CB utförde LC-MS/MS-och GC-MS-analyserna. ZB utförde de statistiska analyserna. Alla författare bidrog till manuskriptrevisionen och godkände den inlämnade versionen.
finansiering
detta arbete stöddes av National Institutes of Health (1r15a|111328-01) och Davis Family Endowment till PA.
intressekonflikt
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
bekräftelser
vi tackar Allan Knopf och Dan Langhorst för hjälp med att mäta hormontitrarna. Vi tackar också David Denlinger för användbara kommentarer om tidigare versioner av manuskriptet. Användning av handelsnamn eller kommersiella produkter i denna artikel är enbart i syfte att tillhandahålla specifik information och innebär inte rekommendation eller godkännande av United States Department of Agriculture. USDA är en lika möjlighet leverantör och arbetsgivare.
Kompletterande Material
R Kärngrupp (2019). R: ett språk och en miljö för statistisk databehandling. Wien: R Core Team.
Google Scholar
V Askorremo, L., Nielsen, J. och Nookaew, I. (2013). Berika genuppsättningsanalysen av genomövergripande data genom att införliva riktning av genuttryck och kombinera statistiska hypoteser och metoder. Nukleinsyror Res. 41, 4378-4391. doi: 10.1093 / nar / gkt111
PubMed Abstrakt / CrossRef fulltext / Google Scholar