Generiskt Namn: natriumpolystyrensulfonat
doseringsform: oralt, rektalt pulver
medicinskt granskat av Drugs.com. Senast uppdaterad den 21 september 2020.
- översikt
- biverkningar
- dosering
- professionell
- interaktioner
- mer
- Kalexatpulver beskrivning
- Kalexatpulver – klinisk farmakologi
- indikationer och användning för Kalexatpulver
- kontraindikationer
- varningar
- försiktighetsåtgärder
- läkemedelsinteraktioner
- ammande mödrar
- pediatrisk användning
- biverkningar
- överdosering
- Kalexatpulver dosering och administrering
- hur levereras Kalexatpulver
- PAKETETIKETT.HUVUDDISPLAYPANEL
- mer om Kalexat (natriumpolystyrensulfonat)
- Konsumentresurser
- professionella resurser
- relaterade behandlingsguider
Kalexatpulver beskrivning
natriumpolystyrensulfonat, USP, är en bensen, dietylpolymer, med etenylbensen, Sulfonerad, natriumsalt och har följande strukturformel:
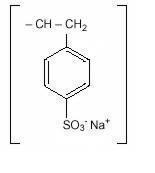
läkemedlet är en kräm till ljusbrun finmalt, pulveriserad form av natriumpolystyrensulfonat, ett katjonbytarharts framställt i natriumfasen med en in vitro-utbyteskapacitet på ungefär 3.1 mEq (in vivo cirka 1 mEq) kalium per gram. Natriumhalten är cirka 100 mg (4,1 mEq) per gram av läkemedlet. Det kan administreras oralt eller i enema.
Kalexatpulver – klinisk farmakologi
när hartset passerar längs tarmen eller behålls i tjocktarmen efter administrering av enema, frigörs natriumjonerna delvis och ersätts av kaliumjoner. För det mesta sker denna åtgärd i tjocktarmen, som utsöndrar kaliumjoner i högre grad än tunntarmen. Effektiviteten i denna process är begränsad och oförutsägbart variabel. Det approximerar vanligtvis ordningen på 33 procent men intervallet är så stort att definitiva index för elektrolytbalans måste övervakas tydligt.
metabola data är inte tillgängliga.
indikationer och användning för Kalexatpulver
natriumpolystyrensulfonat, USP är indicerat för behandling av hyperkalemi.
kontraindikationer
natriumpolystyrensulfonat, USP är kontraindicerat under följande förhållanden: patienter med hypokalemi, patienter med tidigare överkänslighet mot polystyrensulfonathartser, obstruktiv tarmsjukdom, nyfödda med nedsatt tarmmotilitet (postoperativt eller läkemedelsinducerat) och oral administrering hos nyfödda (se försiktighetsåtgärder).
varningar
tarmnekros: fall av tarmnekros, som kan vara dödliga och andra allvarliga gastrointestinala biverkningar (blödning, ischemisk kolit, perforering) har rapporterats i samband med natriumpolystyrensulfonat, USP-användning. Majoriteten av dessa fall rapporterade samtidig användning av sorbitol. Riskfaktorer för gastrointestinala biverkningar var närvarande i många av fallen inklusive prematuritet, historia av tarmsjukdom eller kirurgi, hypovolemi och njurinsufficiens och misslyckande. Samtidig administrering av sorbitol rekommenderas inte (se försiktighetsåtgärder, läkemedelsinteraktioner).
alternativ terapi vid svår hyperkalemi
eftersom effektiv sänkning av serumkalium med natriumpolystyrensulfonat kan USP ta timmar till dagar, behandling med detta läkemedel ensam kan vara otillräcklig för att snabbt korrigera svår hyperkalemi associerad med tillstånd av snabb vävnadsnedbrytning (t.ex. brännskador och njursvikt) eller hyperkalemi så markerad att den utgör en medicinsk nödsituation. Därför bör andra slutgiltiga åtgärder, inklusive dialys, alltid övervägas och kan vara nödvändiga.
hypokalemi
Allvarlig kaliumbrist kan uppstå vid behandling med natriumpolystyrensulfonat, USP. Effekten måste kontrolleras noggrant genom frekventa serumkaliumbestämningar inom varje 24-timmarsperiod. Eftersom intracellulär kaliumbrist inte alltid återspeglas av serumkaliumnivåer, måste nivån vid vilken behandling med natriumpolystyrensulfonat, USP ska avbrytas bestämmas individuellt för varje patient. Viktiga hjälpmedel för att göra denna bestämning är patientens kliniska tillstånd och elektrokardiogram. Tidiga kliniska tecken på svår hypokalemi inkluderar ett mönster av irritabel förvirring och fördröjda tankeprocesser.
Elektrokardiografiskt är svår hypokalemi ofta förknippad med ett förlängt Q-T-intervall, utvidgning, utplattning eller inversion av T-vågen och framträdande U-vågor. Dessutom kan hjärtarytmier förekomma, såsom för tidiga atriella, nodala och ventrikulära sammandragningar och supraventrikulära och ventrikulära takykardier. De toxiska effekterna av digitalis kommer sannolikt att överdrivas. Markerad hypokalemi kan också uppenbaras av svår muskelsvaghet, som ibland sträcker sig till frank förlamning.
elektrolytstörningar
liksom alla katjonbytarhartser, natriumpolystyrensulfonat, är USP inte helt selektiv (för kalium) i sina åtgärder, och små mängder andra katjoner som magnesium och kalcium kan också gå förlorade under behandlingen. Följaktligen bör patienter som får natriumpolystyrensulfonat, USP övervakas för alla tillämpliga elektrolytstörningar.
systemisk alkalos
systemisk alkalos har rapporterats efter katjonbytarhartser administrerades oralt i kombination med icke-absorberbara katjondonerande antacida och laxermedel såsom magnesiumhydroxid och aluminiumkarbonat. Magnesiumhydroxid ska inte administreras med natriumpolystyrensulfonat, USP. Ett fall av grand mal-anfall har rapporterats hos en patient med kronisk hypokalcemi av njursvikt som fick natriumpolystyrensulfonat, USP med magnesiumhydroxid som laxermedel. (Se försiktighetsåtgärder, läkemedelsinteraktioner.)
försiktighetsåtgärder
försiktighet rekommenderas när natriumpolystyrensulfonat administreras USP till patienter som inte tål ens en liten ökning av natriumbelastningar (dvs svår hjärtsvikt, svår hypertoni eller märkt ödem). I sådana fall kan kompensationsbegränsning av natriumintag från andra källor anges.
vid kliniskt signifikant förstoppning, behandling med natriumpolystyrensulfonat, bör USP avbrytas tills normal tarmrörelse återupptas (se varningar, tarmnekros).
läkemedelsinteraktioner
antacida
samtidig oral administrering av natriumpolystyrensulfonat, USP med icke-absorberbara katjondonerande antacida och laxermedel kan minska hartsens kaliumbytesförmåga.
icke-absorberbara katjondonerande antacida och laxermedel
systemisk alkalos har rapporterats efter katjonbytarhartser administrerades oralt i kombination med icke-absorberbara katjondonerande antacida och laxermedel såsom magnesiumhydroxid och aluminiumkarbonat. Magnesiumhydroxid ska inte administreras med natriumpolystyrensulfonat, USP. Ett fall av grand mal-anfall har rapporterats hos en patient med kronisk hypokalcemi av njursvikt som fick natriumpolystyrensulfonat, USP med magnesiumhydroxid som laxermedel.
tarmobstruktion på grund av konkretioner av aluminiumhydroxid vid användning i kombination med natriumpolystyrensulfonat har USP rapporterats.
Digitalis
de toxiska effekterna av digitalis på hjärtat, särskilt olika ventrikulära arytmier och A-V-nodal dissociation, kommer sannolikt att överdrivas av hypokalemi, även inför serumdigoxinkoncentrationer i ”normalområdet”. (Se varningar).
Sorbitol
samtidig användning av Sorbitol med natriumpolystyrensulfonat, USP har varit inblandad i fall av tarmnekros, vilket kan vara dödligt. Samtidig administrering rekommenderas därför inte. (Se varningar).
litium
natriumpolystyrensulfonat, USP kan minska absorptionen av litium.
tyroxin
natriumpolystyrensulfonat, USP kan minska absorptionen av tyroxin.
karcinogenes, mutagenes, nedsatt fertilitet
studier har inte utförts.
graviditetskategori C
reproduktionsstudier på djur har inte utförts med natriumpolystyrensulfonat, USP. Det är inte heller känt om natriumpolystyrensulfonat, USP kan orsaka fosterskador vid administrering till en gravid kvinna eller kan påverka reproduktionskapaciteten. Natriumpolystyrensulfonat, USP ska endast ges till en gravid kvinna om det är klart nödvändigt.
ammande mödrar
det är inte känt om detta läkemedel utsöndras i bröstmjölk. Eftersom många läkemedel utsöndras i bröstmjölk, bör försiktighet utövas när natriumpolystyrensulfonat, USP administreras till en ammande kvinna.
pediatrisk användning
effektiviteten av natriumpolystyrensulfonat, USP hos barn har inte fastställts. Hos nyfödda, natriumpolystyrensulfonat, bör USP inte ges oralt. Hos både barn och nyfödda bör särskild försiktighet iakttas vid rektal administrering, eftersom överdriven dosering eller otillräcklig utspädning kan leda till påverkan av hartset.
på grund av risken för matsmältningsblödning eller tarmnekros bör särskild försiktighet iakttas hos prematura spädbarn eller spädbarn med låg födelsevikt.
biverkningar
natriumpolystyrensulfonat, USP kan orsaka viss grad av gastrisk irritation. Anorexi, illamående, kräkningar och förstoppning kan uppstå, särskilt om höga doser ges. Hypokalemi, hypokalcemi, hypomagnesemi och signifikant natriumretention och deras relaterade kliniska manifestationer kan också förekomma (se varningar). Ibland utvecklas diarre. Stora doser hos äldre individer kan orsaka fekal impaktion (se försiktighetsåtgärder). Sällsynta fall av tarmnekros har rapporterats. Tarmobstruktion på grund av konkretioner av aluminiumhydroxid, vid användning i kombination med natriumpolystyrensulfonat, USP, har rapporterats.
följande händelser har rapporterats från hela världen efter marknadsintroduktion:
överdosering
överdosering kan leda till elektrolytstörningar inklusive hypokalemi, hypokalcemi och hypomagnesemi .Biokemiska störningar till följd av överdosering kan ge upphov till kliniska tecken och symtom på hypokalemi, inklusive: irritabilitet, förvirring, fördröjda tankeprocesser, muskelsvaghet, hyporeflexi, som kan utvecklas till frank förlamning och/eller apnea. Tetany kan förekomma. Elektrokardiografiska förändringar kan överensstämma med hypokalemi eller hyperkalcemi; hjärtarytmier kan uppstå. Lämpliga åtgärder bör vidtas för att korrigera serumelektrolyter (kalium, kalcium, magnesium) och hartset bör avlägsnas från matsmältningskanalen genom lämplig användning av laxermedel eller lavemang.
Kalexatpulver dosering och administrering
Suspension av detta läkemedel bör vara nyberedd och inte lagras längre än 24 timmar.
den genomsnittliga dagliga vuxendosen av hartset är 15 g till 60 g. Detta tillhandahålls bäst genom att administrera 15 g (ungefär 4 nivå teskedar) natriumpolystyrensulfonat, USP en till fyra gånger dagligen. Ett gram natriumpolystyrensulfonat, USP innehåller 4,1 mEq natrium; en nivå tesked innehåller cirka 3,5 g natriumpolystyrensulfonat, USP och 15 mEq natrium. (En hög tesked kan innehålla så mycket som 10 g till 12 g natriumpolystyrensulfonat, USP.) Eftersom In Vivo-effektiviteten hos natrium-kaliumbytarhartser är ungefär 33 procent, levereras ungefär en tredjedel av hartsens faktiska natriuminnehåll till kroppen.
hos mindre barn och spädbarn bör lägre doser användas genom att som vägledning använda en hastighet på 1 mEq kalium per gram harts som grund för beräkning.
varje dos ska ges som en suspension i en liten mängd vatten eller, för större smaklighet, i sirap. Mängden vätska varierar vanligtvis från 20 mL till 100 mL, beroende på dosen, eller kan helt enkelt bestämmas genom att tillåta 3 mL till 4 mL per gram harts. Vårdpersonal bör följa fullständiga aspiration försiktighetsåtgärder vid administrering av denna produkt, såsom att placera och hålla patienten i upprätt läge medan hartset administreras.
hartset kan införas i magen genom ett plaströr och, om så önskas, blandas med en diet som är lämplig för en patient vid njursvikt.
hartset kan också ges, men med mindre effektiva resultat, i ett lavemang bestående (för vuxna) av 30 g till 50 g var sjätte timme. Varje dos administreras som en varm emulsion (vid kroppstemperatur) i 100 mL vattenhaltig vehikel. Emulsionen bör omröras försiktigt under administrering. Enema bör behållas så länge som möjligt och följas av en rengörande enema.
efter en initial rengörande lavemang sätts ett mjukt, stort gummirör (franska 28) in i ändtarmen på ett avstånd av cirka 20 cm, med spetsen väl in i sigmoid-kolon och tejpas på plats. Hartset suspenderas sedan i lämplig mängd vattenhaltigt fordon vid kroppstemperatur och införs genom gravitation, medan partiklarna hålls i suspension genom omrörning. Suspensionen spolas med 50 mL eller 100 mL vätska, varefter röret kläms fast och lämnas på plats. Om ryggläckage uppstår, höjs höfterna på kuddar eller en knä-bröstposition tas tillfälligt. En något tjockare suspension kan användas, men man bör se till att ingen pasta bildas, eftersom den senare har en kraftigt reducerad utbytesyta och kommer att vara särskilt ineffektiv om den deponeras i rektal ampulla. Suspensionen hålls i sigmoid-kolon i flera timmar, om möjligt. Därefter bevattnas kolon med nonsodiuminnehållande lösning vid kroppstemperatur för att avlägsna hartset. Två liter spolningslösning kan vara nödvändig. Avkastningen dräneras ständigt genom en Y-röranslutning. Medan användning av sorbitol inte rekommenderas, bör särskild uppmärksamhet ägnas åt detta rengörande lavemang om sorbitol har använts
intensiteten och varaktigheten av behandlingen beror på svårighetsgraden och resistensen hos hyperkalemi.
natriumpolystyrensulfonat, USP bör inte värmas för att göra det kan förändra hartsens utbytesegenskaper.
hur levereras Kalexatpulver
natriumpolystyrensulfonat, USP finns som kräm till ljusbrunt, finmalt pulver i burkar om 1 pund (454 g),
NDC 10702-036-45.
Butiken vid 20° till 25°C (68° och 77°F) med utflykter tillåten mellan 15° till 30°C (59° och 86°F) .
endast Rx
Tillverkad av:
KVK-TECH INC.
110 Terry enhet
Newtown, PA 18940 USA.
artikel-ID # 006067/04
tillverkarens kod: 10702 10/13
PAKETETIKETT.HUVUDDISPLAYPANEL
454 g Burketikett
NDC 10702-036-45
natriumpolystyrensulfonat, USP
KATJONBYTARHARTS
454 g
endast Rx
genomsnitt dos för vuxna: 15 g (ungefär 4 nivå teskedar) en till fyra gånger dagligen i vatten. Se fullständig förskrivningsinformation.
effekten måste kontrolleras noggrant genom frekventa serumkaliumbestämningar inom varje 24-timmarsperiod. Natriumhalt ca 60 mEq per 15 g.
Suspension ska vara nyberedd och inte förvaras längre än 24 timmar. Dispensera i täta, ljusbeständiga behållare enligt definitionen i den officiella kompendia.
Butiken vid 20° till 25°C (68° och 77°F) med utflykter tillåten mellan 15° till 30°C (59° och 86°F) .
KVK-TECH, INC.

| KALEXATE sodium polystyrene sulfonate powder |
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
|
||||||||||||||||||
Labeler-KVK-Tech, Inc. (173360061)
Registrant-KVK-Tech, Inc. (173360061)
| etablering | |||
| namn | adress | ID / FEI | operationer |
| KVK-Tech, Inc. | 173360061 | tillverkning(10702-036) | |
mer om Kalexat (natriumpolystyrensulfonat)
- biverkningar
- under graviditet eller amning
- doseringsinformation
- läkemedelsinteraktioner
- prissättning & kuponger
- spanska
- läkemedelsklass: katjonbytarhartser
- FDA varningar (2)
Konsumentresurser
- patientinformation
professionella resurser
- förskrivningsinformation
- natriumpolystyrensulfonat oralt pulver (FDA)
andra märken Kayexalate, Kionex
relaterade behandlingsguider
- hyperkalemi
Medicinsk ansvarsfriskrivning