doseringsform: aerosol, skum
medicinskt granskad av Drugs.com. Senast uppdaterad den Sep 1, 2019.
- översikt
- biverkningar
- dosering
- professionell
- graviditet
- mer
- indikationer och användning för Ketokonazolskum
- Ketokonazolskum dosering och administrering
- doseringsformer och styrkor
- Kontraindikationer
- varningar och försiktighetsåtgärder
- Kontaktsensibilisering
- brandfarligt innehåll
- systemiska effekter
- biverkningar
- kliniska prövningar upplever
- dermala säkerhetsstudier
- erfarenhet efter marknadsföring
- användning i specifika populationer
- graviditet
- amning
- kvinnor och män med Reproduktionspotential
- pediatrisk användning
- geriatrisk användning
- Ketokonazolskum beskrivning
- Ketokonazolskum-klinisk farmakologi
- verkningsmekanism
- farmakodynamik
- farmakokinetik
- mikrobiologi
- icke-klinisk toxikologi
- karcinogenes, mutagenes, nedsatt fertilitet
- kliniska studier
- hur levereras / förvaras och hanteras
- Patientrådgivningsinformation
- bruksanvisning
- patientinformation
- förpackning/etikett HUVUDDISPLAYPANEL – kartong
- mer om ketokonazol aktuellt)
- Consumer resources
- Professional resources
- Related treatment guides
indikationer och användning för Ketokonazolskum
Ketokonazolskum, 2% indikeras för topisk behandling av seborrheisk dermatit hos immunkompetenta patienter 12 år och äldre.
användningsbegränsningar
säkerhet och effekt av Ketokonazolskum, 2% för behandling av svampinfektioner har inte fastställts.
Ketokonazolskum dosering och administrering
Ketokonazolskum, 2% ska appliceras på det eller de drabbade områdena två gånger dagligen i fyra veckor.
håll behållaren upprätt och dispensera Ketokonazolskum, 2% i locket på burken eller annan sval yta i en mängd som är tillräcklig för att täcka det eller de drabbade områdena. Dispensering direkt på händerna rekommenderas inte, eftersom skummet börjar smälta omedelbart vid kontakt med varm hud. Plocka upp små mängder Ketokonazolskum, 2% med fingertopparna och massera försiktigt in i det eller de drabbade områdena tills skummet försvinner. För hårbärande områden, dela håret, så att Ketokonazolskum, 2% kan appliceras direkt på huden (snarare än på håret).
Undvik kontakt med ögon och andra slemhinnor. Ketokonazolskum, 2% är inte för oftalmisk, oral eller intravaginal användning.
doseringsformer och styrkor
Ketokonazolskum, 2% innehåller 20 mg ketokonazol, USP per gram, levereras i 50 g och 100 g Behållare.
Kontraindikationer
Ingen.
varningar och försiktighetsåtgärder
Kontaktsensibilisering
Ketokonazolskum, 2% kan resultera i kontaktsensibilisering, inklusive fotoallergenicitet.
brandfarligt innehåll
innehållet i Ketokonazolskum, 2% inkluderar alkohol och propan/butan, som är brandfarliga. Undvik brand, låga och/eller rökning under och omedelbart efter applicering. Punktera inte och / eller förbränna behållarna. Utsätt inte behållare för värme och/eller förvara dem vid temperaturer över 120 F (49 C).
systemiska effekter
hepatit har setts med oralt administrerat ketokonazol (1:10 000 rapporterade incidens). Sänkta testosteron–och ACTH-inducerade kortikosteroidserumnivåer har setts med höga doser oralt administrerat ketokonazol. Dessa effekter har inte setts med topisk ketokonazol.
biverkningar
kliniska prövningar upplever
eftersom kliniska prövningar utförs under mycket varierande förhållanden kan biverkningar som observerats i kliniska prövningar av ett läkemedel inte direkt jämföras med frekvensen i kliniska prövningar av ett annat läkemedel och kanske inte återspeglar de frekvenser som observerats i praktiken. Biverkningsinformationen från kliniska prövningar ger emellertid en grund för att identifiera de biverkningar som verkar vara relaterade till narkotikamissbruk och för att approximera frekvensen.
säkerhetsdata som presenteras i Tabell 1 återspeglar exponering för Ketokonazolskum, 2% hos 672 personer, 12 år och äldre med seborrheisk dermatit. Ämnen applicerade Ketokonazolskum, 2% eller fordonsskum två gånger dagligen i 4 veckor till drabbade områden i ansiktet, hårbotten och/eller bröstet. Biverkningar som uppträder hos > 1% av patienterna presenteras i Tabell 1.
Tabell 1: Biverkningar rapporterade av >1% försökspersoner i kliniska prövningar
|
biverkningar |
Ketokonazolskum, 2% N = 672 n (%) |
Fordonsskum N = 497 n (%) |
|
personer med biverkning |
188 (28%) |
122 (25%) |
|
bränning på applikationsstället |
67 (10%) |
49 (10%) |
|
reaktion vid appliceringsstället |
41 (6%) |
24 (5%) |
reaktioner på applikationsstället som rapporterades hos <1% av patienterna var torrhet, erytem, irritation, parestesi, klåda, utslag och värme.
dermala säkerhetsstudier
i en fotoallergenicitetsstudie hade 9 av 53 försökspersoner (17%) reaktioner under utmaningsperioden på både bestrålade och icke-bestrålade ställen behandlade med Ketokonazolskum, 2%. Ketokonazolskum, 2% kan orsaka kontaktsensibilisering.
erfarenhet efter marknadsföring
följande biverkningar har identifierats under användning efter marknadsföring av Ketokonazolskum, 2%:
magtarmkanalen: keilit
allmänna symtom och / eller symtom vid administreringsstället: smärta och brännskador vid appliceringsstället
hud och subkutan vävnad: Hud brännande känsla och erytem
eftersom dessa händelser rapporteras frivilligt från en population av osäker storlek, är det inte alltid möjligt att på ett tillförlitligt sätt uppskatta deras frekvens eller upprätta ett orsakssamband med läkemedelsexponering.
användning i specifika populationer
graviditet
Risköversikt
det finns inga tillgängliga data om Ketokonazolskum, 2% användning hos gravida kvinnor för att identifiera en läkemedelsassocierad risk för större fosterskador, missfall eller negativa resultat från mödrar eller foster. Inga reproduktionsstudier på djur har utförts med Ketokonazolskum, 2%. I reproduktionsstudier på djur med dräktiga möss, råttor och kaniner observerades både embryotoxiska effekter och utvecklingseffekter (strukturella avvikelser) efter oral dosering av ketokonazol under organogenes. Förutsatt ekvivalent systemisk absorption av topiska och orala ketokonazoldoser och ett Ketokonazolskum, 2% maximal rekommenderad human dos (MRHD) på 8 gram (motsvarande 160 mg ketokonazol), observerades embryotoxiska effekter vid 0, 8 till 2, 4 gånger MRHD och utvecklingseffekter observerades vid 4.8 gånger MRHD .
bakgrundsrisken för större fosterskador och missfall för den angivna populationen är okänd. Alla graviditeter har en bakgrundsrisk för fosterskador, förlust eller andra negativa resultat. I den amerikanska befolkningen är den uppskattade bakgrundsrisken för stora fosterskador och missfall i kliniskt erkända graviditeter 2 till 4% respektive 15 till 20%.
Data
djurdata
djurmultiplarna av beräkningar av exponering för människa baseras på jämförelser av kroppsyta (BSA) av orala doser administrerade till djur och ett Ketokonazolskum, 2% maximal rekommenderad humandos (MRHD) på 8 gram (motsvarande 2,67 mg ketokonazol/kg/dag för en 60 kg individ eller 98,8 mg ketokonazol/m2/dag).
embryofetala utvecklingsstudier har utförts på möss, råttor och kaniner med oralt administrerat ketokonazol. Vid oral administrering till möss på graviditetsdagar 6 till 18 (som täckte organogenesperioden) var ketokonazol embryotoxiskt (25 mg/kg och högre; 0,8 gånger MRHD baserat på BSA-jämförelser) med hög förekomst av resorptioner, ökat antal dödfödda och försenad förlossning. Förseningar i mognad observerades också. Det fanns inga tecken på maternell toxicitet eller missbildningar vid upp till 50 mg/kg (1, 5 gånger MRHD baserat på BSA-jämförelser). Inga behandlingsrelaterade utvecklingseffekter observerades vid 10 mg / kg (0,3 gånger MRHD baserat på BSA-jämförelser).
i närvaro av maternell toxicitet hos råttor var oralt administrerat ketokonazol både embryotoxiskt (40 mg/kg och högre; 2,4 gånger MRHD baserat på BSA-jämförelser), inklusive ökade resorberade foster och dödfödda, och teratogena (80 mg/kg och högre; 4,8 gånger MRHD baserat på BSA-jämförelser), inklusive syndactylia, oligodactylia, viftade revben och gomspalt. Dessutom var 100 mg/kg (6 gånger MRHD baserat på BSA-jämförelser) ketokonazol oralt administrerat på en enda dag under dräktigheten (graviditetsdagar 9 till 12) embryotoxiskt (ökade resorptioner). Samma orala dos som ges på dräktighetsdag 12, 13, 14 eller 15 inducerade externa missbildningar inklusive gomspalt, mikromelia och digitala anomalier (brachydactyly, ectrodactyly, syndactyly).
hos dräktiga kaniner oralt administrerade ketokonazol observerades tecken på embryotoxicitet (ökade resorptioner) vid 10 mg/kg (1, 2 gånger MRHD baserat på BSA-jämförelser) och högre och en ökad incidens av skelettabnormaliteter observerades vid 40 mg/kg (4, 8 gånger MRHD baserat på BSA-jämförelser).
amning
Risköversikt
det finns ingen information tillgänglig om förekomsten av ketokonazol i bröstmjölk eller effekterna på det ammade barnet eller effekterna på mjölkproduktionen efter topisk applicering av Ketokonazolskum, 2% till kvinnor som ammar. I djurstudier hittades ketokonazol i mjölk efter oral administrering. Utvecklings-och hälsofördelarna med amning bör övervägas tillsammans med moderns kliniska behov av Ketokonazolskum, 2% och eventuella negativa effekter på det ammade barnet från Ketokonazolskum, 2% eller från det underliggande moderns tillstånd.
kvinnor och män med Reproduktionspotential
infertilitet
i fertilitetsstudier på djur på råttor och hundar resulterade administrering av orala doser av ketokonazol mellan 3-dagars och 3-månadersperioder i infertilitet som var reversibel .
pediatrisk användning
säkerheten och effektiviteten hos Ketokonazolskum, 2% hos barn under 12 år har inte fastställts.
av de 672 försökspersoner som behandlades med Ketokonazolskum var 2% i de kliniska studierna 44 (7%) från 12 till 17 år. .
geriatrisk användning
av de 672 försökspersoner som behandlades med Ketokonazolskum var 2% i de kliniska studierna 107 (16%) 65 år och äldre.
kliniska prövningar av Ketokonazolskum, 2% inkluderade inte tillräckligt antal försökspersoner i åldern 65 år och äldre för att avgöra om de svarar annorlunda än yngre försökspersoner.
Ketokonazolskum beskrivning
Ketokonazolskum, 2% innehåller 2% ketokonazol USP, ett antimykotiskt medel, i ett termolabilt hydroetanoliskt skum för topisk applicering.
det kemiska namnet för ketokonazol är piperazin, 1-acetyl-4-metoxi]fenyl] -, cis-med molekylformeln C26H28CI2N4O4 och en molekylvikt av 531,43.
följande är den kemiska strukturen:
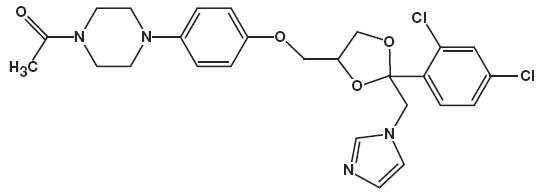
Ketokonazolskum, 2% innehåller 20 mg ketokonazol per gram i ett termolabilt hydroetanoliskt skumfordon bestående av cetylalkohol, citronsyra, etanol (denaturerad med tert-butylalkohol och brucinsulfat) 58%, polysorbat 60, kaliumcitrat, propylenglykol, renat vatten och stearylalkohol trycksatt med ett kolväte (propan/butan) drivmedel.
Ketokonazolskum-klinisk farmakologi
verkningsmekanism
verkningsmekanismen för ketokonazol vid behandling av seborrheisk dermatit är inte känd.
farmakodynamik
farmakodynamiken för Ketokonazolskum, 2% har inte fastställts.
farmakokinetik
i en biotillgänglighetsstudie applicerade 12 personer med måttlig till svår seborrheisk dermatit 3 g Ketokonazolskum, 2% två gånger dagligen i 4 veckor. Cirkulerande plasmanivåer av ketokonazol var < 6 ng/mL för en majoritet av patienterna (75%), med en maximal nivå på 11 ng/mL observerad hos en patient.
mikrobiologi
ketokonazol är ett antimykotiskt medel som hämmar syntesen in vitro av ergosterol, en nyckelsterol i cellmembranet i Malassezia furfur. Den kliniska betydelsen av antifungal aktivitet vid behandling av seborrheisk dermatit är inte känd.
icke-klinisk toxikologi
karcinogenes, mutagenes, nedsatt fertilitet
långtidsstudier på djur har inte utförts för att utvärdera den karcinogena eller fotokarcinogena potentialen hos Ketokonazolskum, 2%.
i orala karcinogenicitetsstudier på mus (18 månader) och råtta (24 månader) vid dosnivåer på 5, 20 och 80 mg/kg/dag var ketokonazol inte karcinogent. Den höga dosen i dessa studier var ungefär 2, 4 till 4, 8 gånger MRHD baserat på BSA-jämförelser. I en bakteriell omvänd mutationstest uttryckte ketokonazol ingen mutagen potential. I tre in vivo-analyser (systerkromatidbyte hos människor, dominerande dödliga och mikronukleustester hos möss) uppvisade ketokonazol ingen genotoxisk potential.
i fertilitetsstudier på djur försämrade Oralt ketokonazol både han-och hon fertilitet hos råttor på ett DOS-och durationsberoende sätt. Hos kvinnor hade orala doser upp till 40 mg/kg (2, 4 gånger MRHD baserat på BSA-jämförelser) ingen effekt på fertiliteten, medan doser på 75 mg/kg (4, 5 gånger MRHD baserat på BSA-jämförelser) och högre minskade graviditetsfrekvensen och antalet implantationsställen. Hos hanråttor minskade peroral dosering vid 200 mg/kg/dag (12 gånger MRHD baserat på BSA-jämförelser) under tre dagar fertiliteten och 400 mg/kg/dag (24 gånger MRHD baserat på BSA-jämförelser) under tre dagar resulterade i en fullständig förlust av fertiliteten. Vid administrering under längre tid (upp till 3 månader) observerades minskad fertilitet hos hanråttor vid doser så låga som 24 mg/kg/dag (1, 4 gånger MRHD baserat på BSA-jämförelser). Hos manliga beaglehundar, en oral dos på 25 mg/kg/dag ketokonazol i upp till 4 veckor (5.2 gånger MRHD baserat på BSA-jämförelser) resulterade i minskad spermierörlighet, minskat spermierantal, ökad onormal sperma och atrofi hos testiklarna. Dessa effekter vändes efter avbrytande av behandlingen.
kliniska studier
säkerheten och effekten av Ketokonazolskum, 2% utvärderades i en randomiserad, dubbelblind, vehikelkontrollerad studie på patienter 12 år och äldre med mild till svår seborrheisk dermatit. I försöket fick 427 försökspersoner Ketokonazolskum, 2% och 420 försökspersoner fick fordonsskum. Ämnen applicerade Ketokonazolskum, 2% eller fordonsskum två gånger dagligen i 4 veckor till drabbade områden i ansiktet, hårbotten och/eller bröstet. Den totala sjukdomens svårighetsgrad i form av erytem, skalning och induration bedömdes vid baslinjen och vecka 4 på en 5-punkts Prövares statisk Global bedömning (ISGA) skala.
behandlingsframgång definierades som att uppnå en vecka 4 (slutet av behandlingen) ISGA-poäng på 0 (klar) eller 1 (majoriteten av lesionerna har individuella poäng för skalning, erytem och induration som är i genomsnitt 1 ) och minst två grader av förbättring från baslinjen. Resultaten presenteras i Tabell 2. Databasen var inte tillräckligt stor för att bedöma om det fanns skillnader i effekter i undergrupper av ålder, kön eller ras.
Tabell 2: Effektresultat
|
antal ämnen |
Ketokonazolskum, 2% N = 427 n (%) |
Fordonsskum N = 420 n (%) |
|
ämnen som uppnår Behandlingsframgång |
239 (56%) |
176 (42%) |
hur levereras / förvaras och hanteras
Ketokonazolskum, 2% innehåller 20 mg ketokonazol, USP per gram. Det termolabila hydroetanoliska skummet är tillgängligt enligt följande:
NDC 45802-532-32
50 g aluminiumburk
NDC 45802-532-33
100 g aluminiumburk
Förvara vid 20-25-25-C (68 till 77 F). .
förvara inte under kylda förhållanden.
innehållet är brandfarligt. Utsätt inte behållare för värme och/eller förvara vid temperaturer över 49 C (120 F). Förvara inte i direkt solljus.
innehåll under tryck. Punktera inte och / eller förbränna behållaren.
förvaras utom räckhåll för barn.
Patientrådgivningsinformation
se FDA-godkänd patientmärkning (Patient bipacksedel).
instruera patienter om korrekt användning av Ketokonazolskum, 2%.
* Undvik brand, låga och/eller rökning under och omedelbart efter applicering. * Applicera inte Ketokonazolskum, 2% direkt på händerna. Dispensera på en sval yta och applicera på de drabbade områdena med fingertopparna. * Tvätta händerna efter applicering * Ketokonazolskum, 2% kan orsaka hudirritation (brännskador på applikationsstället och/eller reaktioner) • instruera en patient att kontakta en vårdgivare om applikationsområdet visar tecken på ökad irritation och rapportera eventuella tecken på biverkningar.
Tillverkad i Israel
Tillverkad av Perrigo
Yeruham, Israel
distribuerad av
Perrigo Bisexuell
Allegan, MI 49010
www.perrigo.com
Rev 08-18
5k200rcj3
bruksanvisning
Ketokonazolskum, 2%
viktig Information: Ketokonazolskum, 2% är endast avsett för användning på huden. Använd inte Ketokonazolskum, 2% i ögon, mun eller vagina.
Steg 1: Ta bort det klara locket från Ketokonazolskummet, 2% burk.
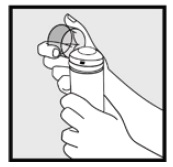
steg 2: håll burken upprätt och tryck fast munstycket för att dispensera Ketokonazolskum, 2% i det klara locket. * Dispensera tillräckligt med Ketokonazolskum, 2% för att täcka hela det eller de drabbade områdena.
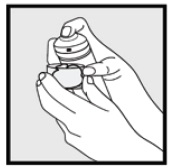
• om burken verkar varm eller skummet verkar rinnande, kör burken under kallt vatten.
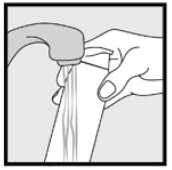
steg 3: plocka upp små mängder Ketokonazolskum, 2% med fingertopparna och gnid försiktigt skummet i det eller de drabbade områdena tills skummet försvinner.
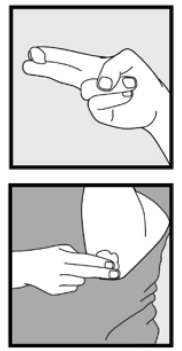
• om du behandlar områden som hårbotten, dela håret så att Ketokonazolskum, 2% kan appliceras direkt på huden.

steg 4: Tvätta händerna efter applicering av Ketokonazolskum, 2%. * Kasta bort något av det oanvända läkemedlet som finns kvar i locket.
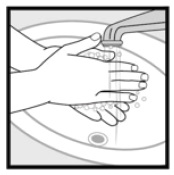
hur ska jag lagra Ketokonazolskum, 2%?
• förvara Ketokonazolskum, 2% vid rumstemperatur mellan 68 kg f till 77 kg F (20 kg C till 25 kg c). * Förvara inte Ketokonazolskummet, 2% burk i kylskåp eller frys. * Håll Ketokonazolskum, 2% borta från värme. Kasta aldrig burken i en eld, även om burken är tom. * Förvara inte Ketokonazolskum, 2% Vid temperaturer över 120 kg f (49 kg C). * Bryt inte igenom (punktera) Ketokonazolskummet, 2% burk.
förvara Ketokonazolskum, 2% och alla läkemedel utom räckhåll för barn.
denna bruksanvisning har godkänts av US Food and Drug Administration.
endast Rx
Tillverkad i Israel
Tillverkad av Perrigo
Yeruham, Israel
distribuerad av
Perrigo Ukrainian
Allegan, MI 49010
www.perrigo.com
Rev 08-18
patientinformation
Ketokonazolskum, 2%
viktig Information: Ketokonazolskum, 2% är endast avsett för användning på huden. Använd inte Ketokonazolskum, 2% i ögon, mun eller vagina.
Vad är Ketokonazolskum, 2%?
Ketokonazolskum, 2% är ett receptbelagt läkemedel som används på huden (aktuellt) för att behandla Seborrheisk dermatit hos personer 12 år och äldre med ett normalt immunsystem.
det är inte känt om Ketokonazolskum, 2% är säkert och effektivt när det används för att behandla svampinfektioner.
det är inte känt om Ketokonazolskum, 2% är säkert och effektivt hos barn under 12 år.
innan du använder Ketokonazolskum, 2%, berätta för din vårdgivare om alla dina medicinska tillstånd, inklusive om du:
• är gravid eller planerar att bli gravid. Det är inte känt om Ketokonazolskum, 2% kommer att skada ditt ofödda barn. * ammar eller planerar att amma. Det är inte känt om Ketokonazolskum, 2% passerar in i bröstmjölken. Prata med din vårdgivare om det bästa sättet att mata ditt barn under behandling med Ketokonazolskum, 2%.
berätta för din vårdgivare om alla läkemedel du tar, inklusive receptbelagda och receptfria läkemedel, vitaminer och växtbaserade kosttillskott.
hur ska jag använda Ketokonazolskum, 2%?
* använd Ketokonazolskum, 2% exakt som din vårdgivare säger att du ska använda den. Se den detaljerade ”bruksanvisningen” i slutet av denna bipacksedel för anvisningar om hur du applicerar Ketokonazolskum, 2% på rätt sätt. * Applicera Ketokonazolskum, 2% på det drabbade hudområdet 2 gånger varje dag i 4 veckor. Du bör applicera tillräckligt med Ketokonazolskum, 2% för att täcka hela det eller de drabbade områdena. * Tala med din vårdgivare om din hud inte förbättras efter 4 veckors behandling med Ketokonazolskum, 2%. * Dispensera Ketokonazolskum, 2% direkt i locket. Dispensera inte Ketokonazolskum, 2% direkt på händerna, eftersom skummet börjar smälta vid kontakt med varm hud. * Tvätta händerna efter applicering av Ketokonazolskum, 2%.
Vad ska jag undvika när jag använder Ketokonazolskum, 2%?
• Ketokonazolskum, 2% är brandfarligt. Undvik eld, lågor eller rökning under och direkt efter att du har applicerat Ketokonazolskum, 2% på huden. * Undvik att få Ketokonazolskum, 2% i eller nära dina ögon, mun, läppar eller vagina. Om du får Ketokonazolskum, 2% på dina läppar eller i dina ögon, mun eller vagina, skölj väl med vatten.
vilka är de möjliga biverkningarna av Ketokonazolskum, 2%?
Ketokonazolskum, 2% kan orsaka allvarliga biverkningar, inklusive:
• hudirritation på applikationsområdet, inklusive hudreaktioner orsakade av exponering för ljus. Berätta för din vårdgivare om du utvecklar hudirritation under behandling med Ketokonazolskum, 2%.
de vanligaste biverkningarna av Ketokonazolskum, 2% inkluderar brännande, torrhet, rodnad, irritation, domningar, klåda, utslag och värme på applikationsstället.
dessa är inte alla möjliga biverkningar av Ketokonazolskum, 2%.
Ring din läkare för medicinsk rådgivning om biverkningar. Du kan rapportera biverkningar till FDA på 1-800-FDA-1088.
hur ska jag förvara Ketokonazolskum, 2%?
• förvara Ketokonazolskum, 2% vid rumstemperatur mellan 68 kg f till 77 kg F (20 kg C till 25 kg c). * Förvara inte Ketokonazolskummet, 2% burk i kylskåp eller frys. * Håll Ketokonazolskum, 2% borta från värme. Kasta aldrig Ketokonazolskummet, 2% burk i eld, även om burken är tom. * Förvara inte Ketokonazolskum, 2% Vid temperaturer över 120 kg f (49 kg C). * Bryt inte igenom (punktera) Ketokonazolskummet, 2% burk. Förvara Ketokonazolskum, 2% och alla läkemedel utom räckhåll för barn.
allmän information om säker och effektiv användning av Ketokonazolskum, 2%.
läkemedel ordineras ibland för andra ändamål än de som anges i en patientinformationsbroschyr. Använd inte Ketokonazolskum, 2% för ett tillstånd för vilket det inte var föreskrivet. Ge inte Ketokonazolskum, 2% till andra människor, även om de har samma symtom som du har. Det kan skada dem. Du kan fråga din apotekspersonal eller vårdgivare om information om Ketokonazolskum, 2% som är skrivet för vårdpersonal.
vilka är ingredienserna i Ketokonazolskum, 2%?
aktiv ingrediens: ketokonazol
Inaktiva Ingredienser: cetylalkohol, citronsyra, etanol (denaturerad med tert-butylalkohol och brucinsulfat) 58%, polysorbat 60, kaliumcitrat, propylenglykol, renat vatten och stearylalkohol trycksatt med ett kolväte (propan/butan) drivmedel
för mer information, ring Perrigo på 1-866-634-9120
denna patientinformation broschyr har godkänts av USA.food and Drug Administration.
förpackning/etikett HUVUDDISPLAYPANEL – kartong
endast Rx
Ketokonazolskum, 2%
endast för lokal användning.
inte för oftalmisk, Oral eller Intravaginal användning.
100 g

följande bild är en platshållare som representerar produktidentifieraren som antingen är fäst eller tryckt på läkemedelsförpackningens etikett under förpackningsoperationen.

| ketokonazol ketokonazol aerosol, skum |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
Labeler-Perrigo New York Inc (078846912)
mer om ketokonazol aktuellt)
- biverkningar
- under graviditet eller amning
- doseringsinformation
- jämför alternativ
- prissättning & kuponger
- spanska
- 36 recensioner
- läkemedelsklass: topical antifungals
Consumer resources
- Patient Information
- Ketoconazole Topical (Advanced Reading)
Professional resources
- Prescribing Information
- Ketoconazole (Topical) (Professional Patient Advice)
- Ketoconazole Cream (FDA)
- Ketoconazole Shampoo (FDA)
Other brands Nizoral Shampoo, Ketodan, Extina, Xolegel
Related treatment guides
- Seborrheic Dermatitis
- Cutaneous Candidiasis
- Androgenetic Alopecia
- Dandruff
- … + 4 fler
Medicinsk ansvarsfriskrivning