| Forfatter | Tilknytning |
|---|---|
| Lindsay A. Weiner, MD | Universitetet I Maryland Medisinske Senter, Baltimore, Maryland |
| George Willis, MD | University Of Maryland School Of Medicine, Institutt For Akuttmedisin, Baltimore, Maryland |
| Zachary D. W. Dezman, MD, MS, MS | University Of Maryland School Of Medicine, Institutt For Akuttmedisin, Baltimore, Maryland |
| Laura J. Bontempo, MD, Med | University Of Maryland School Of Medicine, Institutt For Akuttmedisin, Baltimore, Maryland |
Case presentasjon
Case diskusjon
Case outcome
Resident diskusjon
Endelig diagnose
viktige undervisningspunkter
CASE PRESENTASJON
EN 52 år gammel kvinne kom til akuttmottaket (ED) for hemodialyse (HD) på grunn av terminal nyresykdom (ESRD). Hun hadde tilbrakt de foregående ukene på et eksternt sykehus som ble behandlet for lungebetennelse og bakteriemi med daptomycin. Hun forlot deretter medisinsk råd (AMA) etter å ha fjernet dialysekateteret. Hun presenterte FOR VÅR ED fordi hun trengte hs vaskulær tilgang plassering og re-initiering av dialysebehandlinger. Hennes medisinske historie omfattet kronisk nyresykdom sekundært til hypertensiv nefrosklerose, anemi, hypertensjon, dype venøse tromboser (DVT), systemisk lupus erythematosus og en anfallssykdom av ukjent etiologi.
pasienten, Et Jehovas Vitne, nektet blodtransfusjoner; derfor ble hennes anemi behandlet med intravenøs (IV) administrering av jern, epoetin alfa og folat. Andre medisiner inkluderte nifedipin, klonidin, metoprolol, sevelamer og prednison. Hun var allergisk mot amoksicillin, azitromycin, hydralazin, labetolol, linezolid, morfin og vancomycin. Hun rapporterte tidligere IV heroinbruk mange ar tidligere og tidligere royking. Hun nektet alkoholbruk eller nåværende narkotika-eller tobakksbruk.
ved ankomst var hun våken og i ingen akutt nød med feber på 38.3° Celsius, puls på 87 slag per minutt( bpm), blodtrykk på 110/65 millimeter kvikksølv (mmHg), respirasjonsfrekvens på 17 puste per minutt og pulsoksymetri på 99% ved pusteromsluft. Hun veide 80 kilo og var 5 føtter 6 inches høy. Hodet hennes var normocephalisk og atraumatisk med fuktige slimhinner. Elevene var anicteric, like, runde og reaktive til lys og overnatting. Nakken var smidig og uten lymfadenopati eller ømhet. Lungene hennes hadde grove pustelyder med milde bibasilar knitrer, men ingen wheezes eller rhonchi. Det var ingen tilbaketrekninger eller økt pustearbeid. Hennes hjerte var av vanlig hastighet og rytme uten bilyd, gnir, eller galopp. Hennes mage var myk med normal tarm lyder og uten oppblåsthet, ømhet, rebound, eller vokter. Det var ingen costovertebral vinkel ømhet. Nedre ekstremiteter hadde 1 + pitting ødem, 2 + dorsalis pedis pulser, og var uten ømhet eller deformitet. Pasienten hadde normal styrke og muskelton gjennom alle ekstremiteter med intakt følelse. Gamle fistler var tilstede i venstre og høyre øvre ekstremiteter uten følbar spenning. Hun var våken og orientert til person, sted og tid.
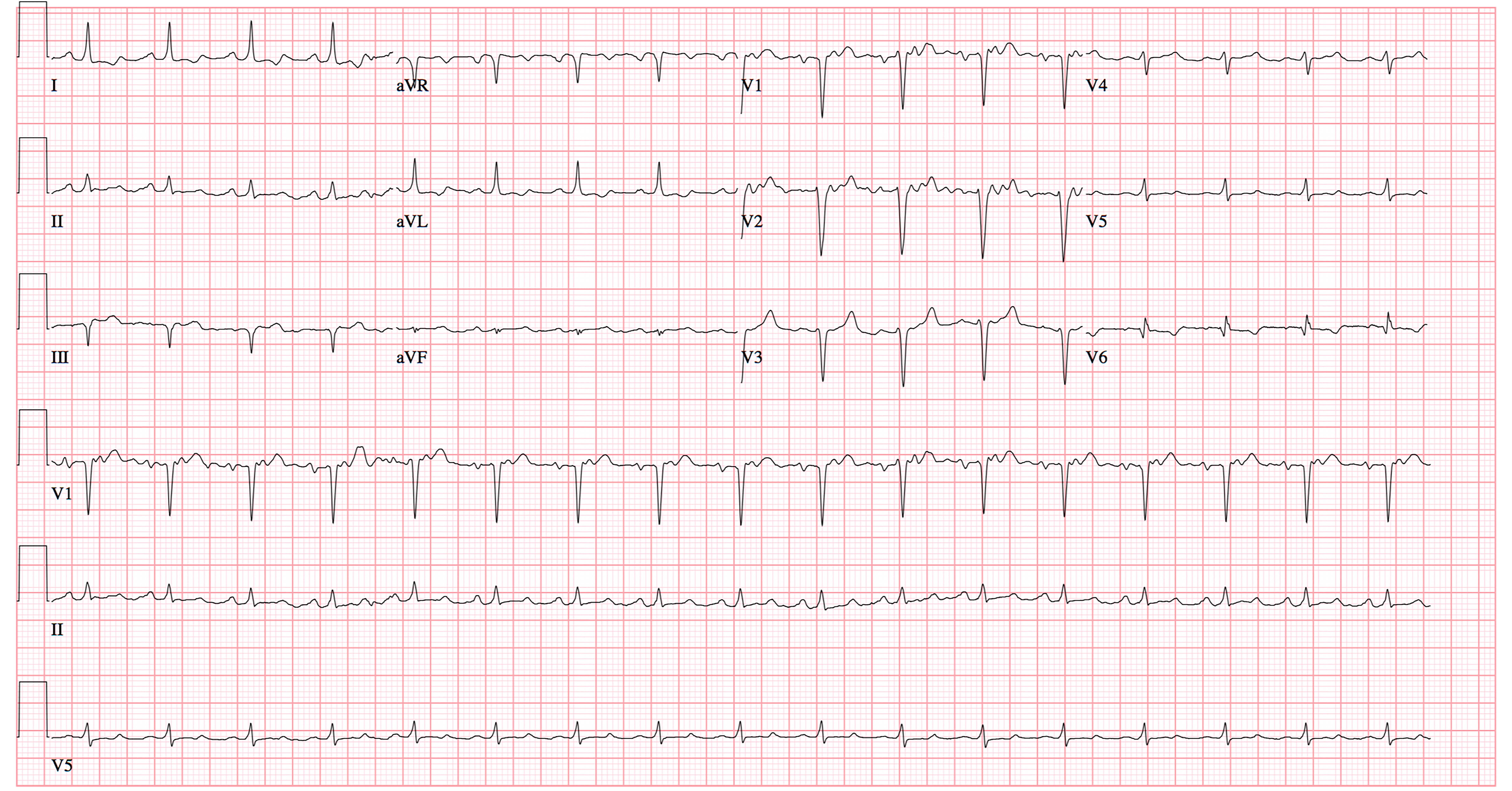
pasientens innledende laboratorieverdier er vist I Tabell 1. Disse var signifikante for en svak leukocytose, anemi til 5,3 g / dL, trombocytopeni, hyperkalemi og forhøyet kreatinin på 11,9 mg/dL. Hennes første elektrokardiogram (EKG) viste en sinus takykardi med t-bølge inversjoner i fører I og V6 (Bilde 1). Dette var uendret fra ET TIDLIGERE EKG. Pasienten ble innlagt på medisinlaget og ble startet på daptomycin. Mens man ventet på sengeplassering, ble et ikke-tunnelt venstre femoral dialysekateter satt inn av medical intensive care unit (ICU) fellow for initiering AV HS. Plasseringen ble bekreftet av den enkle ulempen med blod fra alle porter. Under samtykkeprosessen for kateterplassering ble det dokumentert at pasienten uttalte at hun » heller ville dø enn å motta blodtransfusjoner.»Etter kateterplassering ble DET forsøkt å starte HS, men hun ble hypotensiv og klaget over svakhet nesten umiddelbart. Hennes vitale tegn under det første forsøket PÅ HS var et blodtrykk på 85/56 mmHg med en hjertefrekvens på 105 bpm.
| Verdier | |
|---|---|
| Totalt antall blodceller | |
| Antall Hvite blodlegemer | 12,4 K / mcl |
| Hemoglobin | 5,3 g / dL |
| Hematokrit | 15.8% |
| Platelets | 133 K/mcl |
| Basic metabolic panel | |
| Sodium | 135 mmol/L |
| Potassium | 5.8 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 27 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 189 mg/dL |
| Calcium | 7.2 mg / dL |
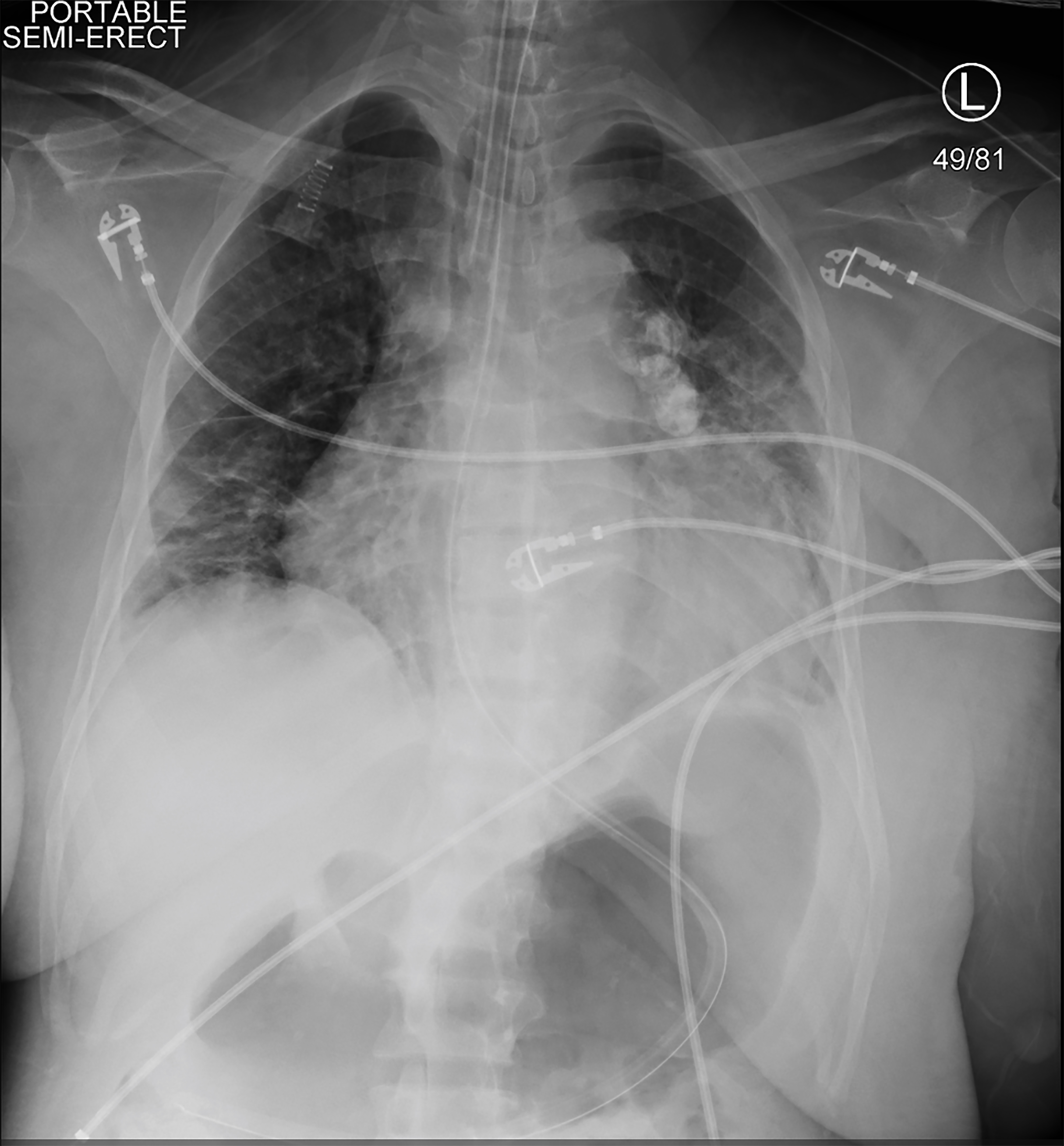
fordi pasienten var symptomatisk og hypotensiv under HS, ble kontinuerlig nyresubstitusjonsbehandling (CRRT) initiert. Kort tid etterpå ble hun hypotensiv, reagerte ikke, og hadde et tonisk klonisk anfall. Vitale tegn på den tiden var en hjertefrekvens på 113 bpm, blodtrykk 75/48 mmHg, respirasjonsfrekvens på 20 puste per minutt og oksygenmetning på 78% på romluft. En kort, gjentatt fysisk eksamen viste at pasienten ikke reagerte på smertefulle stimuli, og elevene hennes var like og reaktive. Hun ble gitt 4 mg lorazepam og intubert for luftveisbeskyttelse. En høyre arteriell femoral linje og en høyre femoral trippel lumen venøs sentral linje ble plassert. En bryst røntgen bekreftet endotrakeal tube plassering (Bilde 2). CRRT ble stoppet, men pasienten forble i sjokk til tross for bolusinfusjoner av krystalloid, så vasopressorer ble startet. Hun fikk eskalerende doser av vasopressorer når gjentatte laboratorieverdier indikerte et hemoglobin på 1,6 g / Dl (Tabell 2).
| Values (prior value) | |
|---|---|
| Complete blood cell count | |
| White blood cell count | 13.4 K/mcl (12.4 K/mcl) |
| Hemoglobin | 1.6 g/dL (5.3 g/dL) |
| Hematocrit | 5.7% (15.8%) |
| Platelets | 167 K/mcl (133K/mcl) |
| Complete metabolic panel | |
| Sodium | 131 mmol/L |
| Potassium | 6.7 mmol/L |
| Chloride | 99 mmol/L |
| Bicarbonate | 14 mmol/L |
| Blood urea nitrogen | 56 mg/dL |
| Creatinine | 11.9 mg/dL |
| Glucose | 169 mg/dL |
| Alanine aminotransferase | 23 u/L |
| Aspartate aminotransferase | 31 u/L |
| Alkaline phosphatase | 145 u/L |
| Total bilirubin | 0.4 mg / dL |
| totalt protein | 5,8 g / dL |
| Albumin | 3,2 g / dL |
| Laktat | 15 e/L |
| Arteriell blodgass | |
| pH | 7.23 |
| PCO2 | 28 mmHg |
| PO2 | 214 mmHg |
Kort tid etter gikk hun inn i hjertestans med en rytme av pulsløs elektrisk aktivitet (PEA). Retur av spontan sirkulasjon ble oppnådd etter seks minutter med kardiopulmonal gjenopplivning. Økt abdominal distention ble observert under gjenoppliving; derfor ble et trykkfølende urinkateter introdusert. Hennes maksimale luftveis – og blæretrykk ble målt på henholdsvis 60 cmH2O og 50 mmHg. Kirurgi ble deretter konsultert. En massiv transfusjonsprotokoll ble initiert etter at hennes nærmeste ble enige om å tillate transfusjon av blodprodukter. En fokusert vurdering med sonography for trauma (FAST) ble utført, og viste fri væske I Morrisons pose. Etter hvert som gjenopplivende tiltak ble videreført, ble det oppnådd en ytterligere studie og en diagnose ble gjort.
CASE DISKUSJON
denne saken presentert med en unik og circuitous sekvens av hendelser som spiraled svært raskt i en uheldig retning. Når presentert med pasienter som har vage eller minimale klager, er det påhviler leverandører å søke etter ledetråder for å bistå i å gjøre diagnosen. Derfor begynte jeg med å søke etter ledetråder i dette tilfellet.
pasienten presentert med en sjef klage av trenger dialyse. Hun hadde nylig blitt innlagt på et annet anlegg for lungebetennelse og bakteriemi og hadde hennes HD kateter fjernet på grunn av mistanke om linje sepsis. HUN logget UT AMA fra dette anlegget etter å ha mottatt daptomycin. Det er ukjent hvor lenge HUN hadde vært UTEN HS eller om hun avsluttet antibiotikakuren før hun dro. Imidlertid er hun i hovedsak asymptomatisk.
hennes tidligere medisinske historie er kjent for anfall samt Dvt og anemi. Det er ingen omtale av noen antikoagulant eller antiepileptika, noe som indikerer at hun enten ikke husker navnene på hennes medisiner eller hun ikke tok noen. Av notatet, hun Er Et Jehovas Vitne og derfor fått alternative behandlinger for hennes anemi, inkludert jern, folat, og epogen.
hennes fysiske eksamen viser at hun er febril, men med ellers stabile vitale tegn. Jeg forventer dette med tanke på at hun hadde forlatt det andre anlegget og sannsynligvis ikke fullførte antibiotikakurset for lungebetennelse og bakteriemi. Andre muligheter inkluderer en infeksjon resistent mot antibiotika eller en nyervervet nosokomial infeksjon fra hennes tidligere sykehusopphold. Hun har noen grove pustelyder og bibasilar knitrer på hennes lunge eksamen, som bekrefter hennes lungebetennelse historie. Lungebetennelse er mest sannsynlig kilden til hennes feber samt bakteriemi, som kanskje ikke presentere med symptomer.
hennes laboratoriestudier avslørte noen relevante funn. Hun var anemisk så vel som hyperkalemisk. Hun var også hypokalsemisk og hyperfosfatemisk. Hun hadde også litt mild uremi. De fleste av disse funnene ville være noe forventet hos EN ESRD-pasient. Anemi kan være et resultat av nyresykdom. Andre muligheter på differensialdiagnose for anemi inkluderer blødning, jernmangel og folatmangel. Hun klager ikke over noe blodtap, og vi har heller ikke de røde blodcelleindeksene som det gjennomsnittlige korpuskulære volumet for å kunne gjøre disse alternative diagnosene på dette punktet. Hennes hyperkalemi er mest sannsynlig fra hennes mangel PÅ HS. Hennes hyperfosfatemi er også mest sannsynlig fra mangel PÅ HD; imidlertid kan daptomycin også forårsake hyperfosfatemi.
mens hun venter på sengeplassering, har HUN HS startet der hun begynner å klage på å føle seg svak og er kjent for å bli hypotensiv og takykardisk. HUN har DERETTER CRRT initiert og forblir hypotensiv, blir hypoksisk, svarer ikke og har en tonisk-klonisk anfall som krever intubasjon og vasopressor initiering. Eksamen viser like og reaktive elever i en pasient som ikke reagerer på smertefulle stimuli. Laboratoriestudier avslører en dypt forverret anemi, forverring av hyperkalemi og intervallutvikling av laktacidose. Hun går deretter inn I EN ERTARREST og, etter vellykket retur av spontan sirkulasjon, har blodtransfisert. Hun er imidlertid fortsatt hypotensiv og hypoksisk til tross for intubasjon. Hun har også en oppblåst mage og topp luftveistrykk større enn 60 cmH2O. EN RASK eksamen avslører fri væske I Morrisons pose.
En slik dyp statusendring etter en terapeutisk inngrep krever alvorlig tanke. La oss starte med hypotensjon og takykardi under HD og påfølgende CRRT. Hypotensjon UNDER HS er absolutt mulig med høyere strømningshastigheter. CRRT har imidlertid mye langsommere strømningshastigheter, og hypotensjon er mindre hyppig når CRRT brukes. Så hvorfor er denne personen i sjokk og krever vasopressorer etter oppstart AV HS?
når jeg nærmer meg pasienter med sjokk, kommer mnemonic SJOKK (septisk/spinal; hypovolemisk; obstruktiv; kardiogen; anafylaktisk-K som i melkesyre) til tankene mine. Sepsis er sikkert mulig, gitt hennes historie om bakteriemi. Det er imidlertid mindre sannsynlig å være årsaken til en slik dyp dekompensasjon, spesielt med en akutt utbrudd i innstillingen for å starte HD. Hypovolemisk eller hemorragisk sjokk er en annen mulighet. Hun har risikofaktorer for både som hun kan være på antikoagulasjon med sin HISTORIE MED DVT, samt muligens ha uremisk blodplate funksjonsfeil. Dette må undersøkes nærmere. Obstruktiv sjokk som i lungeemboli eller tamponade er en annen mulighet. Hun har sikkert risikofaktorer for DETTE med SIN HISTORIE MED DVT og ukjent antikoagulasjonsstatus. Hun er også hypoksisk, noe som ikke forklares av lungebetennelse fordi hennes opprinnelige metning var over 95%. Hun kunne også ha utviklet tamponade fra uremisk perikarditt, selv om dette er mindre sannsynlig gitt at hennes blod urea nitrogen (BUN) ikke er signifikant forhøyet, og hun hadde ingen klager på perikarditt symptomer. En annen mulig årsak til hemodynamisk kollaps som fører til obstruktiv sjokk er en luftemboli fra DET nye HD-kateteret og påfølgende initiering AV HD gjennom DET. Fordi dette er mulig, vi trenger å erte dette ut litt mer også.
Kardiogent sjokk er mindre sannsynlig som hun er usannsynlig å ha utviklet en smertefri hjerteinfarkt så alvorlig at hun gikk inn kardiogent sjokk. Anafylaktiske og endokrine problemer er andre mulige årsaker til sjokk. Imidlertid var det ingen medisiner administrert eller noen omtale av utslett eller luftveis kompromiss for å foreslå anafylaksi som en årsak. Endokrine sjokk bør vurderes som hun er på prednison, noe som gjør adrenal insuffisiens en mulig årsak. Hyperkalemi og hyponatremi som du forventer med binyreinsuffisiens er tilstede; det er imidlertid ingen omtale av manglende overholdelse eller oppkast av steroider, noe som gjør denne muligheten mindre sannsynlig.
Anfall under HS er en annen enhet tilstede i dette tilfellet. Hun har en historie med anfall, og ingen antiepileptika er på hennes medisinering liste. Så, hennes anfall kan sikkert være fra manglende overholdelse. Uremisk encefalopati kan presentere som anfall når som helst; BUN er imidlertid bare litt forhøyet, noe som gjør dette usannsynlig. Dialyse ulikevekt syndrom er en annen årsak til anfall under HS. Imidlertid oppstår DET vanligvis under den aller FØRSTE HS-økten og er forbundet med en rask nedgang i BUN. Denne pasienten har vært PÅ HS en stund og BUN er ikke markert forhøyet, noe som gjør denne diagnosen usannsynlig. Til slutt kan redusert perfusjon til hjernen fra hypotensjon under HS indusere anfall. Pasienten ble hypotensiv under HS, noe som kan skje på grunn av høyere strømningshastigheter. Hun ble deretter plassert PÅ CRRT, som bruker en langsommere strømningshastighet og har en mye lavere forekomst av hypotensjon; men hun ble mer hypotensiv. Dette antyder at det mest sannsynlig er en annen årsak til hypotensjonen i stedet for BARE HS.
Hun har også fri væske på SIN RASKE eksamen og har nå en oppblåst mage. Sammen med den dypt forverrede anemi, må jeg anta at hun bløder i magen hennes. Det er ingenting annet enn blødning og hemolyse som kan forklare en så dyp nedgang i hennes hemoglobin, og det er ikke noe bevis for å være mistenkelig for hemolyse i hennes historie, fysisk eksamen eller tilleggsstudier.
pasienten opplever også forhøyet luftveistrykk på ventilatoren. Det er flere grunner til at hennes luftveistrykk kan bli forhøyet; men i innstillingen av en oppblåst mage og hypotensjon kommer abdominal compartment syndrome (ACS) i forkant av mine differensialdiagnoser. Derfor må jeg anta at dette er en relativt rask blødning da hun har falt hennes hemoglobin betydelig, gått i ERTARREST, forbedret med blodtransfusjoner, og krever flere vasopressorer for å opprettholde blodtrykket. Men hvorfor blør hun i magen hennes? Hun har ikke opplevd noe traumer i magen med mindre det skjedde under anfallet på sykehuset; men hvis dette hadde vært tilfelle, ville jeg anta at denne historien ville ha blitt gitt. Hun kunne sikkert ha opplevd en slags aortakatastrofe som en sprukket abdominal aortaaneurisme, men det ville være veldig rart at dette skjedde under HS.
nå måtte jeg ta et skritt tilbake og se de diagnostiske ledetrådene som helhet og sette disse puslespillbitene sammen. Ved å ta hele denne pasientpresentasjonen i sikte, oppstår et felles tema i omtrent alle aspekter av hendelsesforløpet. Blødning. Anemi? Blødning. Hennes anemi forverres? Definitivt blødning. Hypotensjon? Blødning. Anfall? Hypoperfusjon kommer fra hypotensjon som kommer fra blødning. Hypoksi? Dyp anemi, som kommer fra blødning. ACS? Blødning. Melkesyreacidose? Hypotensjon og anemi fra blødning.
nå må vi bare finne ut hvor denne blødningen kommer fra. Når pasienten først presentert hun virket bemerkelsesverdig stabil. Hun hadde ingen klager og hennes vitale tegn, annet enn hennes feber, var innenfor normale grenser. Hun hadde ET HD-kateter plassert uten å nevne komplikasjoner. HUN begynner HS og blodtrykket synker, hjertefrekvensen øker, og hun blir symptomatisk nesten umiddelbart. JEG kunne lett skylde PÅ HS som årsak; men hennes leverandører initierer CRRT og hennes hypotensjon forverres, noe SOM gjør HS mindre sannsynlig å være årsaken. Derfor har noe skjedd før oppstart AV HS, da HUN var stabil frem TIL HD begynte. Det eneste som skjedde før oppstart AV HS var plasseringen AV HS-kateteret. Det er ingen omtale av noen komplikasjoner eller signifikant blodtap under plasseringen. Det er imidlertid den eneste hendelsen mellom pasienten å være stabil og være ustabil.
hvis det ikke var nevnt en åpenbar komplikasjon, hva kunne ha skjedd? Husk at den antatte kilden til blødningen er i magen. HD-kateteret ble plassert i lysken, som ikke ligger langt fra magen og retroperitonealrommet. Hvis leverandøren som plasserte snøret penetrerte den andre siden av karveggen, kunne HAN / hun lett ha plassert HD-kateteret slik at spissen er i retroperitoneum. Hvis det var tilfelle, ville pasienten ekstravasere blod inn i retroperitonealrommet og forårsake hypotensjon, nedsatt perfusjon, laktacidose og dyp anemi. Når retroperitonealrommet fylles opp, ville det være økt intra-abdominal trykk som til slutt fører TIL ACS. En gjennomgang av litteraturen avslører en saksrapport om denne typen komplikasjoner.1
derfor vil den diagnostiske studien jeg utfører, være et datatomografi (CT) angiogram av magen og bekkenet. Dette ville vise hvor HD-kateteret ble plassert og undersøke retroperitoneum for tegn på aktiv blødning.
KASUSUTFALL
den diagnostiske studien var ET CT-angiogram av abdomen og bekkenet. DET venstre femorale HD-kateteret hadde punktert pasientens venstre felles iliac vene og dannet et høyresidig retroperitoneal hematom. Det kirurgiske teamet vurderte pasienten og utførte en temporiserende laparotomi for å behandle hennes akutte ACS. Dette avslørte et stort, høyre sidet retroperitoneal hematom og en stor mengde ascites. Pasientens hemodynamikk stabiliserte seg etter denne prosedyren, og hun var i stand til å komme av alle vasopressorer. Hun ble deretter fraktet direkte til operasjonsstuen med vaskulær kirurgi team for en emergent reparasjon av hennes venstre felles iliac vene.
hun fortsatte å motta flere blodtransfusjoner under reparasjonen. Etterpå ble hun overført til KIRURGISK ICU med en åpen mage som senere ble reparert. Pasienten våknet helt nevrologisk intakt og ble tømt hjem fem uker etter hennes skade.
RESIDENT DISCUSSION
ACS er endepunktet til et spektrum som begynner med intra-abdominal hypertensjon (IAH) og slutter når intra-abdominal trykk overstiger 20 mmHg og ledsages av endeorgandysfunksjon.2 Normalt abdominaltrykk, selv hos kritisk syke pasienter, bør være < 12 mmHg. IAH, som kan graderes i trinn, er definert som et trykk på 12-25 mmHg uten tilstedeværelse av organdysfunksjon.
Det finnes flere forskjellige TYPER ACS. Primær ACS forekommer i traumer eller kirurgiske katastrofer som resulterer i en stor hemorragisk hendelse, som i det presenterte tilfellet.3 Sekundær ACS oppstår når ICU-pasienter blir aggressivt gjenopplivet med store mengder krystalloider.4,5 Mindre vanlige sekundære årsaker inkluderer store, rom-opptar lesjoner, tarm eller retroperitoneal ødem, og pankreatitt. Sekundær ACS er lumsk og blir ofte diagnostisert etter en forsinkelse, noe som ytterligere kompliserer en allerede høy dødelighet.4,5
dødeligheten av ACS skyldes kompromittert organperfusjon og senere organsvikt. I nyrene fører nedsatt nyreperfusjon til overbelastning og oliguri, mens økende trykk i rommet forårsaker direkte kompresjon av orgelet.6,7 Økt splanchnisk vaskulær motstand resulterer i tarmødem, translokasjon av tarmbakterier, hyperlaktemi og sepsis.6,7 Cardiac preload kan reduseres på grunn av kompresjon av den inferior vena cava forårsaker redusert minuttvolum, mens høyre ventrikkel afterload øker.7 Oksygenering er svekket som membranen skyves cephalad og funksjonell restkapasitet reduseres.7 Intrakranielt trykk stiger også som følge av at vena venekompresjon svekker venøs retur. Klinisk vil pasienten oppleve hypotensjon, hypoksi, akutt nyreskade, endret mental status, anfall eller manglende respons; etter hvert opplever pasienten total kardiovaskulær kollaps.6-8
gullstandarden for DIAGNOSTISERING AV ACS er måling av blæretrykk indirekte med et urinkateter.9 for å måle et nøyaktig trykk må pasienten ligge i den bakre posisjonen og målingen tatt ved slutten av utløpet, med transduseren nullet og i tråd med iliac crest. Denne målingen har vist seg å korrelere med direkte målt intra-abdominal trykk.10 Måling av blæretrykk hver 4-6 timer er tilstrekkelig hos kritisk syke pasienter med risiko for Å utvikle ACS.
bærebjelken i behandling FOR ACS er dekompressiv laparotomi, vanligvis krever forlater pasienten med en åpen mage postoperativt.11 andre sekundære temporaliserende tiltak inkluderer sedasjon og analgesi, nevromuskulær lammelse, dekompresjon av tarminnholdet med et naso-eller endogastrisk rør, diuretika og CRRT.11,12
dødeligheten av ACS forblir høy til tross for medisinsk inngrep. Mens dekompressiv laparotomi effektivt umiddelbart reduserer intra-abdominal trykk, er denne prosedyren forbundet med flere medisinske komorbiditeter med en dødelighet som fortsatt er opptil 50%.13 Dette kan skyldes det faktum at pasienter på tidspunktet for dekompressiv laparotomi er kritisk syke og prosedyren anses som en siste utvei.
et annet stort problem for diskusjon i dette tilfellet er det etiske dilemmaet som leverandørene som bryr seg om denne kritisk syke pasienten, hvis religiøse tro var i motsetning til standardbehandlingen (blodprodukttransfusjon) for hennes sykdom. Pasienten hadde innledende dokumentasjon i hennes diagram over lege-pasient samtale der hun uttalte hennes bevisste avslag på blodprodukter. Hun hadde imidlertid ikke skrevet, signert dokumentasjon av blodprodukttransfusjonsavslag i diagrammet. Mens pasienten var bevisstløs og i extremis, hennes mann, som ikke er en praktiserende Jehovas Vitne, reversert sin beslutning i et forsøk på å redde livet hennes. Hvor faller denne beslutningen i balansen mellom autonomi vs. kraften til de pårørende til å bestemme hvilke medisinske inngrep en pasient skal motta? Hva skjer når pårørende tar en beslutning som er imot pasientens valg? I liv-eller-død situasjoner med etiske dilemmaer, hvor raske beslutninger vil avgjøre pasientens utfall, hvordan kan denne byrden plasseres på kjære?
det etiske dilemmaet ligger derfor i ideen om at mens transfusjon bryter verdien av autonomi, oppfyller den samtidig det etiske begrepet velgjørenhet. Generelt bør pasientens personlige direktiver ha forrang over eventuelle beslutninger som er gjort av den medisinske fullmektigen. Familiens beslutning om å transfisere på vegne av den ubevisste pasienten, som sett i dagens tilfelle, er imidlertid juridisk hensiktsmessig, selv om den bryter med pasientens autonomi.
etikkutvalget ble konsultert etter at pasienten allerede hadde fått en massiv transfusjon av blodprodukter og fortsatte å motta ytterligere røde blodcelletransfusjoner. Komiteen anbefalte at pasienten ikke lenger får blodoverføringer til tross for samtykke fra pårørende. Pasienten våknet helt nevrologisk intakt og ble informert om blodtransfusjonene. Hun bestemte seg for at hun i fremtiden bare ville akseptere blodbankplasma og familiedonerte røde blodlegemer under en akutt hendelse. Pasienten ble tømt hjem fem uker etter hennes iatrogen skade.
ENDELIG DIAGNOSE
iatrogen venstre felles iliac veneperforasjon med resulterende abdominale kompartmentsyndrom.
VIKTIGE UNDERVISNINGSPUNKTER
ACS oppstår når intra-abdominal trykk er over 20 mmHg og endeorganskade er tilstede.
Primær ACS er forårsaket av traumer eller kirurgi, men vær oppmerksom på sekundær ACS sett i massiv gjenopplivning, spesielt I Icu.
gullstandarden FOR acs-diagnose er et målt blæretrykk.
Behandling er en laparotomi samt temporiserende tiltak som evakuering av tarminnhold og / eller sedasjon og lammelse.
Dokumentert pasient informert samtykke og / Eller Institutional Review Board godkjenning er innhentet og arkivert for offentliggjøring av denne saksrapporten.
Fotnoter
Seksjonsredaktør: Rick A. McPheeters,DO
Fulltekst tilgjengelig gjennom åpen tilgang på http://escholarship.org/uc/uciem_cpcem
Adresse For Korrespondanse: Laura J. Bontempo, MD, Med, University Of Maryland, Department Of Emergency Medicine, 110 S Paca Street, 6th Floor, Suite 200, Baltimore, MD 21201. Epost: [email protected]. 2:103 – 108
Innsendingshistorikk: Revisjon mottatt 22. januar 2018; Sendt Inn 19. Mars 2018; Akseptert 21. Mars 2018
Interessekonflikter: Ved CPC-EM artikkel innlevering avtalen, alle forfattere er pålagt å avsløre alle tilknytninger, finansieringskilder og økonomiske eller ledelsesforhold som kan oppfattes som potensielle kilder til skjevhet. Forfatterne avslørte ingen.
1. Pafitanis G, Spyridon K, Theodorakopoulou E, et al. En kasusrapport av abdominalkompartmentsyndrom forårsaket av feilstilling av et femoralt venekateter. Int J Surg Sak Rep. 2015; 12: 84-6.
2. Maluso P, Olson J, Sarani b. Hypertensjon I abdominalrom og abdominalromssyndrom. Crit Omsorg Clin. 2016;32(2):213-22.
3. Morken J, West MA. Abdominal compartment syndrom i intensivavdelingen. Curr Opin Crit Omsorg. 2001;7(4):268-74.
4. J. m. wl, M. E. E., M. M., et al. Sekundært abdominalromssyndrom er en svært dødelig hendelse. Er J Surg. 2001; 182 (6): 645-8.
5. Burrows R, Edington J, Robbs JV. En ulv i ulvens klær: abdominal compartment syndrome. S Afr Med J. 1995;85(1):46-8.
6. Caldwell CB, Ricotta JJ. Endringer i visceral blodstrøm med forhøyet intraabdominal trykk. J Surg Res. 1987; 43 (1): 14-20.
7. Jørgensen Z, Jørgensen, et al. Abdominal compartment syndrome: årsaken eller effekten av postinjury multippel organsvikt. Støt. 2003;20(6):483-92.
8. Vidal MG, Ruiz Weisser J, Gonzalez F, Et al. Insidens og kliniske effekter av intra-abdominal hypertensjon hos kritisk syke pasienter. Crit Care Med. 2008;36(6):1823-31.
9. Kron IL, Harman PK, Nolan SP. Måling av intra-abdominal trykk som et kriterium for abdominal re-utforskning. Ann Surg. 1984;199(1):28-30.
10. Saggi BH, Sugerman HJ, Ivatury RR, et al. Abdominal compartment syndrom. J Traumer. 1998;45(3):597-609.
11. Kirpatrick AW, Roberts DJ, De Waele JD, et al. Intra-abdominal hypertensjon og abdominal compartment syndrome: oppdaterte concensus definisjoner og klinisk praksis retningslinjer Fra World Society Of The Abdominal Compartment Syndrome. Intensiv Omsorg Med. 2013;39(7):1190-206.
12. Jeffrey JF, Jeffrey A, Jeffrey CG, et al. Alternativer til formell abdominal dekompresjon. Er Surg. 2011; 77 (Sl): S51-7.
13. De Waele JJ, Host EA, Malbrain ML. Dekompressiv laparotomi for abdominal compartment syndrome-en kritisk analyse. Crit Omsorg. 2006; 10 (2): R51.