Introduksjon
den adaptive strålingen av insekter på tvers av ulike klimaer har blitt tilrettelagt delvis av den gjentatte utviklingen av diapause, en forutseende utviklingsarrest i forkant av ugunstige forhold (f.eks. vinter, tørr sesong; Waterhouse og Norris, 1980; Tauber et al.( 1986; Danks, 1987; Hodkova og Hodek, 2004). Diapause er vanligvis initiert som svar på et token miljøsignal (f. eks., sesongmessig endring i fotoperiode), opprettholdt i en genetisk bestemt periode, og deretter avsluttet etter at gunstige forhold har returnert. Dermed lar diapause insekter justere veksten og reproduksjonen med lokale sesongmessige sykluser (Tauber et al.( 1986; Danks, 1987). Diapause er en viktig regulator av livshistorie, geografisk rekkevidde og sesongmessig overflod for mange insektbestemmere (F. eks., 2013), landbruksskadedyr (f.eks. Pullin et al., 1991; Li et al., 2012; Levine et al., 2015), og sykdomsvektorer (F.eks. Denlinger og Armbruster, 2014; Gray et al., 2016). I tillegg påkaller diapause utbredte fysiologiske modifikasjoner, inkludert akkumulering av næringsreserver, undertrykkelse av metabolsk aktivitet, økt anaerob katabolisme, cellesyklusarrest, endringer I Wnt-signalering og oppregulering av ulike stresstoleransemekanismer (Denlinger, 2002; Hahn og Denlinger, 2007, 2011; King And MacRae, 2015; Ragland and Keep, 2017). Forståelse av reguleringsmekanismer som ligger til grunn for diapause er et langvarig problem i organismebiologi og vil lette utviklingen av nye ledelsesmetoder til nøkkelarter.
Ekdysteroider og juvenile hormoner regulerer et bredt spekter av fysiologiske og utviklingsprosesser i insekter (Gruntenko Og Rauschenbach, 2008; Jindra et al., 2013; Palli, 2016), inkludert diapause (Denlinger, 1985; Denlinger et al., 2012). Det spesifikke hormonelle signalet som regulerer diapause har en tendens til å variere etter scenen hvor utviklingsarrest oppstår (Denlinger Et al., 2012). For eksempel er utviklingsarrest under larval eller pupal diapause vanligvis regulert av endringer i ecdysteroid overflod (For Eksempel Ohtaki Og Takahashi, 1972; Bowen et al., 1984; Richard et al., 1987). I motsetning er utviklingsarrest under voksen diapause ofte regulert av endringer i juvenil hormon overflod (F. Eks. Spielman, 1974; Schooneveld et al., 1977; Saunders et al., 1990 og se anmeldelse I Denlinger et al., 2012).
et stort gap eksisterer i vår forståelse av hormonell regulering av embryonal diapause, som er utbredt over Lepidoptera, Orthoptera, Hemiptera og Diptera. Tidligere forskning har grundig dokumentert endokrin regulering av embryonal diapause i silkeormsmot (Bombyx mori) av diapause hormon (Hasegawa, 1963; Yamashita Og Hasegawa, 1966; Yamashita, 1996). Denne regulatoriske rollen for diapause hormon synes imidlertid å være unik For b. mori og har dermed gitt lite innsikt i det hormonelle grunnlaget for embryonal diapause hos andre arter (Denlinger Et al., 2012). Utover b. mori er hormonell regulering av embryonal diapause blitt etablert i bare tre arter. Sigøynermot (Lymantria dispar) gjennomgår en utviklingsarrest initiert og opprettholdt av høyere overflod av ecdysteroider (Lee et al., 1997; Lee Og Denlinger, 1997) mens lav ecdysteroid overflod regulerer diapause i to gresshopper (Chortoicetes terminifera, Locusta migratoria; Gregg et al., 1987; Tawfik et al., 2002).
Hittil har ingen studie preget hormon overflod under embryonal diapause Av Noen Dipteran arter. Her adresserer vi dette gapet ved å undersøke hormonell regulering av embryonal diapause i Den Asiatiske tigermyggen, aedes albopictus. I løpet av de siste 30 årene har denne medisinsk viktige vektoren (Paupy et al., 2009) har vellykket invadert tempererte regioner over hele verden (Benedict et al., 2007) skyldes delvis en embryonisk diapause som har muliggjort overlevelse under langdistansetransport (Juliano og Lounibos, 2005; Diniz et al., 2017) og utviklet seg raskt for å justere tidspunktet for utviklingsarrest med lokale klimatiske forhold (Urbanski et al., 2012). Tempererte populasjoner Av Ae. albopictus går inn i en maternelt regulert, fotoperiodisk diapause. Under korte, høstlige daylengths produserer kvinner egg som fullfører embryonisk utvikling, men forblir ildfast mot klekkestimuli som pharate larver inne i eggets korion til neste vår. I løpet av det siste tiåret, transkripsjonell regulering av embryonal diapause I Ae. albopictus har blitt omfattende karakterisert (Urbanski et al., 2010; Poelchau et al., 2011, 2013a, b; Huang X. et al., 2015; Jørgen et al., 2017) men den hormonelle reguleringen av denne viktige tilpasningen er fortsatt ukjent. Vi kvantifiserte 20-hydroksyekdyson (20HE) og juvenil hormon III (JH3) i diapausing og ikke-diapausing egg på tre tidspunkter som braketter viktige stadier av embryonisk utvikling og tolket våre resultater i sammenheng med tidligere samlet RNAseq (Poelchau et al., 2013a, b) og manipulerende data (Suman Et al., 2015).
Materialer Og Metoder
Eggsamling
alle målinger brukte F11 egg fra en laboratoriekoloni Av Ae. albopictus etablert i August 2015 fra over 200 larver samlet i Manassas, VA, Usa. Før dette forsøket ble befolkningen opprettholdt under tidligere beskrevne forhold . For å generere eggprøver for dette forsøket ble f10 larver opprettholdt i 5,5 L Sterlittbeholdere med en tetthet på omtrent 250 larver per 2.5 L avionisert (DI) vann med 5 mL matslam (Armbruster og Conn, 2006) under LD fotoperiode ved 21°C og 80% RF. Hver mandag–onsdag–fredag ble larver filtrert gjennom et finmasket nett og deretter overført til en ren 5.5 L Sterlittbeholder; puppene ble distribuert til voksne bur opprettholdt under enten diapause-avvergende LD-fotoperiode eller diapause-induserende, kortdagsfotoperiode (SD, 8:16 L:D).
Voksne kvinner ble gitt ukentlige blodmåltider og en oviposisjonskopp foret med ubleget papirhåndkle og halvfylt MED di-vann til oviposisjonen opphørte. Egg ble samlet daglig, opprettholdt på et vått papirhåndkle i 48 timer, deretter lufttørket og lagret i beholdere under SD-forhold. Ved 5, 7 og 11 dager etter oviposisjon (dpov) ble innsamlede egg veid til nærmeste 1 µ (gjennomsnitt: 11,460 mg, område: 9,1–19,5 mg) på EN mx5 mikrobalanse (Mettler-Toledo, Columbia, OH, Usa), plassert i 1,5 mL rør, snap-frosset i flytende nitrogen mellom 11 og 12 pm (Zeitgeber tid 3-4 timer), og lagret ved -80°C. En undergruppe av egg ble beholdt for å bekrefte AT LD og SD fotoperiode forhold stimulert produksjonen av ikke-diapause og diapause egg, henholdsvis (se Urbanski et al., 2012).
vi samplet egg på 5, 7 og 11 dpov av to grunner. Først, Ae. albopictus initierer diapause (sensu Ko ③t@l, 2006; Ko ③tá Et al., 2017) etter ferdigstillelse av embryonisk utvikling (Mori et al., 1981). Under forholdene som brukes i våre eksperimenter, Ae. albopictus embryoer gjennomgå segmentering på ca 5 dpov og ikke-diapause embryoer er kompetente til å klekkes på ca 7 dpov (Poelchau et al.( 2013a). Ved 11 dpov er utviklingsarrest fast etablert i diapause embryoer (Poelchau et al.( 2013b). Dermed valgte vi å sammenligne diapause og ikke-diapause embryoer på tidspunkter som bracketing perioden med klekkingskompetanse, inkludert etablering av utviklingsarrest under diapause. For det andre valgte vi tidspunkter som var lik de som ble brukt til tidligere rnaseq-eksperimenter av embryoer (Poelchau et al., 2013a, b) slik at disse dataene kan utnyttes for å tolke våre nåværende resultater. Disse rnaseq-resultatene ble tidligere funnet å være godt korrelert med genuttrykksresultater oppnådd via qRT-PCR (Poelchau et al.( 2013a).
Ecdysteroid Kvantifisering
for å trekke ut ecdysteroider ble eggprøver plassert i et borosilikatglass 0,5 mL konisk bunn mikrovevsliperrør (Wheaton, Millville, NJ, Usa) med 1 µ farnesol (Sigma-Aldrich, St. Louis, MO, Usa) lagt til som en intern standard. Eggene ble manuelt homogenisert tre ganger med en teflon-stampe i 300 µ hplc-klasse Kjølt MeOH og spunnet ved 12 000 RCF i 10 minutter i en nedkjølt (4°C) sentrifuge. Den resulterende supernatanten ble samlet og eluert gjennom aluminiumoksydkolonner to ganger med kjølt 90% MeOH og en gang Med MeOH. Prøvene ble tørket ned i en vakuumsentrifuge nedkjølt (4°C), resuspendert i 20 µ MeOH og lagret ved -80°C til analyse. Positive kontroller ble utarbeidet ved å legge til 1 µ hver AV 20he (Sigma-Aldrich) og farnesol til tomme rør som ellers ble behandlet identisk. Prøve analyse av ecdysteroid konsentrasjon ble utført ved Hjelp Av En Mikromass Quattro Micro LC-MS / MS (Waters Co., Milford, MA, Usa). Injeksjonsvolumene var 5.0 µ, med separasjoner utført ved BRUK AV FRIFINNELSE UPLC BEH C18 2.1 mm ved 50 mm kolonner med en 1.7 µ stasjonær fase(Waters Co.). Driftsforholdene for LC-løp var en mobilfasestrømningshastighet på 0,37 mL min-1 med en binær mobilfase på 0,1% maursyre i acetonitril og 0,1% maursyre i vann. Innledende forhold var 1: 99 acetonitril: vann, etterfulgt av isokratisk strømning for 0,3 min. Ved 0,3 min, en lineær gradient fra 1:99 til 99:1 acetonitril:vann ble påført over 4,2 min, etterfulgt av 1,0 min isokratisk strømning ved 99: 1 acetonitril:vann, hvoretter mobilfasen returnerte til 1:99 acetonitril: vann. Massespektrometerinnstillingene var elektrospray positive, med en desolvasjonstemperatur på 350°C. 20he og farnesol eluert ved henholdsvis 2,89 og 4,97 min, og ble kvantifisert ved bruk av multiple reaksjonsovervåking av karakteristiske overganger: henholdsvis 481,22 (m/z) > 445,24 (m/z) og 205,41 (m/z) > 121,09 (m/z). Deteksjonsgrensen for analysen er omtrent 5 pg.
Kvantifisering Av Juvenile Hormoner
Hver eggprøve ble plassert i et borsilikatglass med 0,5 mL konisk bunn mikrovevsliperrør (Wheaton) med 1 µ farnesol (Sigma-Aldrich) tilsatt som en intern standard. Eggene ble manuelt homogenisert tre ganger med en teflon-stampe i kjølt heksan av 500 µ hplc-klasse, og deretter spunnet ved 12 000 RCF i 10 minutter i en nedkjølt (4°C) sentrifuge. Heksanfraksjonene ble rekombinert i et rent borosilikatglassflaske og tørket ved vakuumsentrifugering. JH ble kvantifisert ved bruk av gasskromatografi / massespektrometri som tidligere beskrevet (Brent og Vargo, 2003). Kort sagt ble resten vasket ut av hetteglassene med tre skyll av heksan og tilsatt borosilikatglasskolonner fylt med aluminiumoksid. For å filtrere ut forurensninger ble prøver eluert gjennom kolonnene suksessivt med heksan, 10% etyleter-heksan og 30% etyleter-heksan. Etter tørking ble prøver derivatisert ved oppvarming ved 60°C i 20 minutter i en oppløsning av metyl-d-alkohol (Sigma-Aldrich)og trifluoreddiksyre (Sigma-Aldrich). Prøver ble tørket ned, resuspendert i heksan, og igjen eluert gjennom aluminiumoksid kolonner. Ikke-derivatiserte komponenter ble fjernet med 30% etyleter. Jh-derivatet ble samlet i nye hetteglass ved tilsetning av 50% etylacetat-heksan. Etter tørking ble prøvene resuspendert i heksan, og deretter analysert ved HJELP AV EN HP 7890A – SERIE GC (Agilent Technologies, Santa Clara, CA, Usa) utstyrt med en 30 m × 0,25 mm Zebron ZB – voks kolonne (Phenomenex, Torrance, CA, Usa) koblet til EN HP 5975C inert masse selektiv detektor. Helium ble brukt som bæregass. Jh-skjemaet ble bekreftet ved første løpende testprøver I SKANNEMODUS for kjente signaturer AV JH 0, JH I, JH II, JH3 og jh3 ethyl; JH3 ble bekreftet som den primære endogene formen i denne arten. Etterfølgende prøver ble analysert VED HJELP AV MS SIM-modus, overvåking ved m / z 76 og 225 for å sikre spesifisitet for d3-methoxyhydrinderivatet AV JH3. Total overflod ble kvantifisert mot en standardkurve av derivatisert JH3 og justert for startmassen av egg. Deteksjonsgrensen for analysen er omtrent 1 pg.
Statistiske Analyser
Analyser ble utført I R (R Core Team, 2019). Jh3 overflod ble log-transformert og analysert VED HJELP AV ANOVA for å teste for effekter av diapause status, alder, og deres interaksjon. 20 han overflod var ikke-lineær og passer ved hjelp av to polynomiske regresjonsmodeller: en full modell inkludert alder og utviklingsstatus (diapause, ikke-diapause) og en redusert modell som bare inneholder alder. Modeller ble sammenlignet MED ANOVA for å avgjøre om inkludert utviklingsstatus forbedret forklaringskraften betydelig.
Transkripsjonsanalyser benyttet tidligere innsamlede rnaseq-data fra diapause Og Ikke-diapause Ae. albopictus egg (Supplerende Datasett 1; Poelchau et al., 2013a, b). Differensielt uttrykte gener ved 3, 6 og 11 dpov ble undersøkt ved gensettanrikningsanalyser (Mootha et al., 2003) bruke Pianopakken (Vä Et al., 2013) satt til standardparametere etterfulgt AV fdr-korreksjon. Et referansegensett ble annotert med de biologiske prosessbetingelsene som ble tildelt VectorBase (Giraldo-Calderó et al., 2015). Jh3 og ecdysteroid syntese vei gener SAMT JH3 reseptorer og degradering gener ble manuelt annotert i henhold til tidligere litteratur (Bai et al., 2007; Li et al., 2011; Nouzova et al., 2011; Niwa og Niwa, 2014; Matthews et al., 2016). I tillegg kommenterte VI JH3 og ecdysteroid-inducble gener basert på genbeskrivelser gitt I VectorBase (Giraldo-Calderó et al., 2015). En fullstendig oversikt over disse gensettene er gitt I Supplerende Datasett 1.
Resultater
Gjennomsnittlig forekomst av diapause var 95,9% (variasjonsbredde: 90,5–100%) under SD-fotoperiode og 5.4% (område: 1,8–9,5%) under ld fotoperiode (Supplerende Datasett 2); dermed induserte våre fotoperiodiske behandlinger de forventede diapause-responsene. 20HAN toppet under både diapause og ikke-diapause forhold ved 7 dpov, men inkludert diapause status som en faktor i en kvadratisk modell FOR 20HE overflod forbedret ikke forklaringskraften til modellen (Figur 1a Og Supplerende Datasett 3; F3,43 = 0.21, p = 0.890). Disse resultatene indikerer at diapause status ikke signifikant forklarer variasjon I 20he titer. Analyse av rnaseq indikerte at VERKEN 20he-synteseveien eller de 20he-induserbare genene var signifikant endret under diapause vs. ikke-diapause-tilstander ved 3, 6 eller 11 dpov (Tabell 1).

Tabell 1. Gensett berikelse analyseresultater, se Supplerende Datasett 1 for en fullstendig oppsummering av disse gensettene.
JH3 ble bekreftet å være den primære formen for juvenilt hormon hos denne arten. Jh3 overflod ble signifikant redusert i diapause embryoer (Figur 1b Og Supplerende Datasett 3; F1, 64 = 5.08, p = 0.028). Alder (F2,64 = 0,66, p = 0,518) og interaksjonen mellom diapause status og alder (F2,64 = 0,13, p = 0,883) påvirket IMIDLERTID IKKE jh3-nivåene. Analyse av rnaseq-data indikerte at jh3-synteseveien var signifikant undertrykt ved 3 dpov, og jh-induserbare gener ble signifikant undertrykt ved 6 dpov (Figur 2 Og Tabell 1).
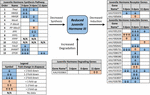
Figur 2. Sammendrag av differensialuttrykk av gener involvert I jh3-syntese, nedbrytning og induksjon for Ae. albopictus (Poelchau et al., 2013a, b). Signifikante diapause-induserte reduksjoner (blå) eller økninger (oransje) indikeres av skyggefulle celler. Differensialstørrelsen er angitt med piler som beskrevet i legenden nederst til venstre. ∗Gener uten vanlige navn identifiseres med Vektorbase ID-nummer.
Diskusjon
Diapause er en utbredt tilpasning som gjør at insekter kan justere veksten og reproduksjonen med sesongmessige gunstige forhold (Tauber et al.( 1986; Danks, 1987). Å forstå de hormonelle endringene som insekter koordinerer oppfatningen av eksterne, diapause-induserende signaler med de fysiologiske mekanismene som fører til utviklingsarrest er et langvarig mål i biologi (Lees, 1956; Denlinger, 2002). Tiår med forskning har ført til identifisering av vanlige hormonelle strategier for diapause ved larve -, pupal-og voksne stadier; den hormonelle reguleringen av embryonal diapause forblir imidlertid stort sett ukjent, spesielt I Diptera (Denlinger, 1985, 2002; Denlinger Et al., 2012). I denne studien er vår direkte måling av redusert jh3 overflod i diapause bekreftet av tidligere genuttrykksprofilering (Poelchau et al., 2013a, b) og manipulerende eksperimenter (Suman Et al., 2015) støtter hypotesen OM AT JH3 regulerer embryonal diapause hos denne arten.
Ecdysteroids
i denne studien målte vi direkte ecdysteroid overflod på tre tidspunkter under diapause og ikke-diapause forhold i embryoer av mygg Ae. albopictus. I samsvar med tidligere resultater Fra Toxorhynchites amboinensis (Russo og Westbrook, 1986), nådde 20he nivåer nær slutten av embryonisk utvikling (7 dpov; Figur 1a). IMIDLERTID var 20he titer ikke signifikant forskjellig mellom diapause og ikke-diapause egg. Videre gjennomgikk verken 20he-synteseveien eller 20he-induserbare gener noen signifikante, koordinerte endringer i genuttrykk (Tabell 1). Vi konkluderer med at, i motsetning til tidligere undersøkte embryonale diapauser I Lepidoptera og Orthoptera (Hasegawa, 1963; Yamashita Og Hasegawa, 1966; Gregg et al., 1987; Yamashita, 1996; Lee og Denlinger, 1997; Lee Et al., 1997; Tawfik et al., 2002), 20han regulerer ikke diapause initiering I Ae. albopictus.
Juvenilt Hormon
i kontrast observerte vi omtrent to ganger lavere jh3 overflod i diapause embryoer (Figur 1b). Mens mindre i størrelse enn forskjeller I jh3 overflod oppdaget under diapause vs ikke-diapause forhold i insekter som diapause på andre livsstadier (f. eks Yin Og Chippendale, 1979; Walker Og Denlinger, 1980; Readio et al., 1999), er våre direkte målinger bekreftet av transkripsjonsbevis (Figur 2). FOR eksempel er jh3-synteseveien signifikant undertrykt under tidlig diapause-forberedelse (3 dpov). Støtte vår tolkning av disse resultatene, tidligere studier har funnet at redusert ekspresjon av gener langs jh3 syntese banen er sterkt korrelert med lavere jh3 overflod i Både Aedes aegypti (Nouzova et al ., 2011; Mikkelsen et al., 2014) Og Diploptera punctata (Huang J. et al., 2015). JH-induserbare gener blir også signifikant undertrykt under sen diapause-forberedelse (6 dpov; Tabell 1), noe som tyder på at diapause-forutbestemte embryoer har en begrenset kapasitet til å reagere PÅ JH3-signalering nær den tiden at ikke-diapause-embryoer blir kompetente til å klekkes. Videre er genuttrykk for ET jh3-nedverdigende enzym (jh esterase)signifikant oppregulert i tidlig diapause vedlikehold (11 dpov; Figur 2) så vel som senere i diapause vedlikehold (21 og 40 Dpov; Poelchau et al., 2013b) tyder PÅ AT JH3 kan forbli i lav overflod gjennom diapause hos denne arten.
Redusert jh3-overflod under utviklingsarrest er noe counterintuitive fordi lav juvenil hormontiter vanligvis er forbundet med progressive molter, spesielt fra larv til puppestadium (Palli, 2016). Imidlertid bruk AV EN jh3 analog (pyriproxyfen) til diapause Ae. albopictus egg akselererer frekvensen av diapause avslutning i en doseavhengig måte (Suman et al., 2015). 80% av pyriproxyfen utsatte egg avslutte diapause ved 30 dpov sammenlignet med bare 1% diapause avslutning av 80 dpov for kontroll egg (Suman et al., 2015). Endringer I jh3 overflod kan også generere en embryonal diapause-lignende fenotype i andre arter. For Eksempel I B. mori, eksperimentell reduksjon AV jh3 syntese AV JHAMT knockout resulterer i fullt utviklede pharate larver som ikke reagerer på klekkestimuli; denne fenotypen kan reddes på en doseavhengig måte ved bruk av enten ekstrahert JH3 eller metopren, EN jh3 analog (Nakao et al ., 2015). Tilsvarende eksperimentell tilskudd av en annen juvenil hormon analog (RO-20-3600) til nylig deponert Drosophila melanogaster egg produserer pharate larver som er mobile i egget, men ikke klarer å klekkes (Smith Og Arking, 1975). Sammen indikerer disse dataene at juvenil hormon overflod sannsynligvis bidrar til regulering av klekkeresponser i ulike insekter. Embryonale diapause på faratet larvestadiet er definert av en unnlatelse av å svare på klekking stimuli dermed, endringer i juvenile hormon overflod kan representere en felles hormonell strategi for å regulere denne formen for diapause.
sammen med tidligere transkripsjonelle og manipulerende data, impliserer våre resultater sterkt redusert jh3 overflod som den sannsynlige regulatoren av embryonal diapause i Ae. albopictus. Denne forskningen er den første direkte kvantifisering av hormon overflod under embryonale diapause i Noen Dipteran arter og representerer et viktig skritt mot å avklare hormonell regulering av denne avgjørende tilpasning til ugunstige miljøer. Å karakterisere sammenhengen mellom ytre stimuli og utviklingsarrest via hormonell signalering forblir en stor utfordring (Denlinger, 1985; Denlinger Et al., 2012). Å belyse disse veiene i en rekke arter vil gi kritisk innsikt for grunnleggende og anvendte problemer, inkludert å forstå det molekylære og fysiologiske grunnlaget for livshistorieutviklingen, forutsi arters respons på klimaendringer og identifisere nye mål for styring Av skadedyr og vektorarter (Denlinger, 2008).
Data Availability Statement
alle datasett generert for denne studien er inkludert i artikkelen / Supplerende Materiale.
Forfatterbidrag
ZB, CB og PA bidro til oppfattelsen, utformingen av studien og utarbeidet det første utkastet til manuskriptet. ZB, MM og JS utførte husdyrhold og samlet eggprøver. CB utførte LC-MS / MS og gc-MS analysene. ZB utførte de statistiske analysene. Alle forfattere bidro til manuskriptrevisjonen og godkjente den innsendte versjonen.
Finansiering
dette arbeidet ble støttet Av National Institutes Of Health (1r15a|111328-01) Og Davis Family Endowment TIL PA.
Interessekonflikter
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Anerkjennelser
vi takker Allan Knopf Og Dan Langhorst for hjelp med å måle hormontiterene. Vi takker Også David Denlinger for nyttige kommentarer til tidligere versjoner av manuskriptet. Bruk av varenavn eller kommersielle produkter i denne artikkelen er utelukkende for det formål å gi spesifikk informasjon og innebærer ikke anbefaling eller godkjenning av United States Department Of Agriculture. USDA er en likestillingsleverandør og arbeidsgiver.
Supplerende Materiale
R Kjerneteam (2019). R: Et Språk Og Miljø For Statistisk Databehandling. Wien: R Kjerneteam.
Google Scholar
Vä, L., Nielsen, J., Og Nookaew, I. (2013). Berikende gensettanalysen av genom-brede data ved å inkorporere retning av genuttrykk og kombinere statistiske hypoteser og metoder. Nukleinsyrer Res. 41, 4378-4391. doi: 10.1093 / nar / gkt111
Pubmed Abstrakt | CrossRef Fulltekst / Google Scholar