Introduksjon
l1-celleadhesjonsmolekylet (L1CAM) er et neuronal celleadhesjonsmolekyl som tilhører immunoglobulin superfamilien; det har nøkkelfunksjoner i utviklingen av nervesystemet (Itoh og Fushiki, 2015). Mutasjoner I L1CAM har vært relatert Til x-bundet nevrologiske syndromer, som er oppsummert Som L1 sykdommer. De er klassifisert som følger: X-bundet hydrocephalus (XLH) på grunn av stenose Av akvedukten Av Sylvius (HSAS), MASA syndrom (intellektuell funksjonshemming, afasi, shuffling gangart, adducted tommelen), spastisk paraparesis type 1 (SP1), Og X-koblet agenesis av corpus callosum (ACC) (Weller og Gartner, 2001; Itoh og Fushiki, 2015).
Omtrent 282 sykdomsfremkallende mutasjoner (DMs) I l1cam-genet er rapportert VED hgmd® Professional 2019.2 (https://portal.biobase-international.com/hgmd/pro/all.php). Endringer I l1cam-genet er varierte; mutasjonsdataanalyser fra 282 pasienter avslører 51% missense-og nonsensmutasjoner, 25% slettinger, 5% innsettinger og 19% endringer i spleisingsstedet, men stille mutasjoner I L1CAM med patogen potensial var sjeldne, og stille mutasjoner ble ofte ignorert, spesielt i wes-deteksjon (whole-exome sequencing).
i denne studien, ved HJELP AV WES, screenet vi fosterets DNA fra En Kinesisk gravid kvinne som har rapportert fem kontinuerlige graviditeter med føtal hydrocephalus; vi fant bare en ny stille mutasjon c. 453G > T (P. Gly151 =) I l1cam-genet. Interessant, gjennom videre analyse, indikerte vi at den stille mutasjonen skapte en potensiell 5 ‘ splice site konsensussekvens, noe som ville resultere i en in-frame sletting av 72 bp fra ekson 5 og 24 aminosyrer AV l1cam-proteinet.
Case Presentasjon
En 28 år gammel frisk kvinne ble henvist til vår klinikk etter fire frivillige svangerskapsavbrudd på grunn av føtal hydrocephalus på andre sykehus. Alle fostre var mannlige. Da hun ankom vårt sykehus (Kvinnesykehus, Medisinsk Skole, Zhejiang University, Zhejiang, Kina), var hun allerede på sin femte graviditet ved 24 ukers svangerskap, med en føtal hydrocephalus ved bildeundersøkelser. For å utforske den genetiske årsaken ble fosterblodprøvetaking utført ved 26 ukers svangerskapsalder. Konvensjonelle cytogenetiske studier ble utført for både foster-og foreldreprøver, og fosterprøven ble videre analysert ved enkeltnukleotidpolymorfisme (SNP) array og WES.
denne studien ble utført I samsvar Med anbefalingene Fra Ethics Committee Of Women ‘ S Hospital, School Of Medicine Zhejiang University, og informert samtykke ble anskaffet fra alle deltakerne i denne studien i samsvar Med Helsinkideklarasjonen. Studieprotokollen ble godkjent av Review Board Of The Women ‘ S Hospital, School Of Medicine, Zhejiang University I Kina.
Materialer Og Metoder
Karyotype Og SNP Array
karyotypene av føtalt ledningsblod og perifert ledningsblod ble bestemt ved konvensjonell karyotyping av minst 30 blodlymfocytter, som ble arrestert ved metafase av kolchiciner. G-banding karyotyper av dyrkede celler ble utført på 320-400-båndnivå med en oppløsning på rundt 10 Mb. SNP-arrayet ble utført Av CytoScan™ HD-arrayet (Affymetrix, USA) i henhold til produsentens instruksjon, med rundt 2.600.000 markører inkludert 750.000 SNP-prober og 1.900.000 ikke-polymorfism-prober for omfattende helgenomdekning. Data ble analysert Av Chromosome Analysis Suite (Chas) programvare (Affymetrix, Santa Clara, CA) basert På GRCh37 / hg19 montering. Rapporteringsterskelen for kopieringsresultatet ble satt til 500 kb med et markørtall på ≥50 for gevinster og på 200 kb med et markørtall på ≥50 for tap.
Hele Eksom-Sekvensering
hoveddelen AV WES ble levert av Beijing Genomics Institute. Genomisk DNA ble ekstrahert av Et DNeasy-Blodsett (Qiagen, CA) og deretter fragmentert Av Covaris LE220 (Massachusetts, USA) for å generere et sammenkoblet bibliotek (200-250 bp). Alle forsterkede biblioteker ble utført PÅ bgiseq-500-plattformen, single-streng DNA ble blandet Med MGIEASY™ DNA Bibliotek Prep Kit V1 (BGI, Shenzhen, Kina) og deretter sekvensert ved HJELP AV 100sr kjemi MED BGISEQ-500RS high-throughput sekvensering Kit (BGI, Shenzhen, Kina).
Ren lesing (med en lengde på 90 bp) avledet fra målrettet sekvensering og filtrering ble deretter justert til human genome reference (hg19) ved Hjelp Av Burrows-Wheeler Aligner (BWA) Multi-Vision programvarepakke (Li Og Durbin, 2009). Etter justering ble utdatafilene brukt til å utføre sekvenseringsdekning og dybdeanalyse av målområdet, single-nucleotidvarianter (SNVs) og indel-kall, vi brukte GATK-programvaren til å oppdage SNVs og indels (McKenna et al., 2010) ble Alle Snver og indels filtrert og estimert via flere databaser, inkludert NATIONAL Center For Biotechnology Information (NCBI) Single-Nucleotide Polymorphism Database (DBSNP), HapMap, 1000 Genomes Project datasett og database med 100 Kinesiske friske voksne. Vi brukte Condel, SIFT, PolyPhen-2, Lrt, Mutation Taster og PhyloP for å forutsi effekten av varianter. Patogene varianter vurderes under protokollen utstedt Av American College Of Medical Genetics and Genomics (Acmg) (Richards et al., 2015). Human Gene Mutation Database (Hgmd) ble brukt til å screene mutasjoner. Alle potensielle patogene varianter ble validert ved Bruk Av Sanger-sekvenseringsmetoder.
Rna-Ekstraksjon, PCR Og Sekvensering
Mononukleære Celler I Perifert blod (Pmbc) og mononukleære celler i ledningsblod (CBMCs) ble isolert ved Ficoll-tetthetsgradientseparasjon. Totalt RNA ble ekstrahert fra PMBCs og CBMCs ved Hjelp Av TRIzol (Takara, Japan). Utdraget total Rna ble omvendt transkribert VED HJELP AV RT Kit (Takara, Japan). PCR ble utført Med GoldStar Best Master Mix (CWBIO, Beijing). Primer sekvenser er oppført: L1CAM-DNA-5F, CCCACCCGTCCTTTCCTA; L1CAM-DNA-5R, CGCTCGTCCTGCTTGATGT; L1CAM-mRNA-4-6-F, GGTGTCCACTTCAAACCCAA; OG L1CAM-mRNA-4-6-R, GCGGCTTCCTGTCAATCA. Sanger-sekvensering ble utført AV EN ABI 3130 DNA-analysator.
Resultater
En 28 år gammel sunn kvinne ble henvist til vår klinikk etter fire frivillige oppsigelser av graviditet på grunn av føtal hydrocephalus. Alle fostre var mannlige (Figur 1a). Den familiære stamtavlen syntes å vise XLH. Hun var allerede her femte graviditet ved 26 ukers svangerskap. Føtal ventrikulomegali ble påvist ved føtal ultralydsskanning OG MR, som konsekvent viste tilstedeværelsen av hydrocephalus. De viste at den bilaterale cerebral ventrikkel og den tredje ventrikkel var åpenbart utvidet, og det var alvorlig hydrocephalus i intracerebral og agenesis av corpus callosum (Figur 1b).
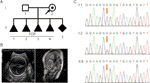
Figur 1 (A) Stamtavle av familien. TOPP, avslutning av graviditet. (B) Imaging undersøkelser av fosteret. Fosterets ultralyd og fosterets MR viste at det var alvorlig hydrocephalus i fosteret. (C) Sekvensanalyse av genomisk DNA fra familiemedlemmer. Genotyper AV L1CAM var vill type, c.453g > T Het, og C.453g > T Hom, i I:1 (ektemann), jeg: 2 (gravid kvinne), OG II: 5 (foster). Mutasjonen er indikert av de røde pilene.
for å undersøke mulig genetisk årsak, utførte vi karyotypeanalyse og SNP-array for å analysere fosterblodprøvetaking og fant ingen positive funn. Choroidal neovaskularisering (CNV) resultat har blitt deponert I Genuttrykket OMNIBUS (GEO); tiltredelsesnummeret ER GSE133063, som vedlagt nedenfor (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE133063).
så oppdaget vi fosteret AV WES. Den analytiske strategien for å finne sannsynlig patogen variantidentifikasjon ble vist I Figur S1. En liste over varianter (Tabell S1) ble oppnådd gjennom screening av variantfrekvenser, mutasjonsstatus og arvemodus. Ved å ta hensyn til de hydrocephalusassosierte genene (HP:0000238, http://compbio.charite.de/hpoweb/showterm?id=HP:0000238#id=HP_0000238) (Tabell S2), var det ingen ytterligere merkbar mutasjon bortsett fra den stille mutasjonen av c. 453G > T i ekson 5 AV l1cam-genet (NM_000425.3). c.453g > T ble ikke rapportert I HGMD og ClinVar og ble ikke funnet i dbsnp, gnomAD og andre datasett. I HENHOLD TIL standarder OG retningslinjer FOR ACMG (Richards et al., 2015), hadde det ennå ikke nådd kriteriet «patogen» eller «sannsynlig patogen», men det var ingen andre potensielle mutasjoner; vi hadde ikke annet valg enn å foreta en videre analyse av den stille mutasjonen som ble funnet.
ifølge tradisjonell tenkning skjedde denne basesubstitusjonen i den tredje basen i kodon 151, som koder for en glycin, og derved skaper en nøytral mutasjon(S. Gly151 =). Denne varianten ble bekreftet I DNA ekstrahert fra føtal ledningsblod og perifert blod i paret Ved Sanger-sekvensering (Figur 1c). Kvinnen bar den heterozygote mutasjonen, og mannen hennes var en villtype genotype.
Med Mutasjonssmak (http://www.mutationtaster.org/), c.453g > T ble skåret som » sykdomsfremkallende.»Det viste at proteinfunksjoner kan bli påvirket og spleisestedet kan endres; vi var nysgjerrige på de potensielle spleisingseffektene AV L1CAM-funksjonen i denne stille mutasjonen. Den stille mutasjonen ble testet ved hjelp av følgende online programvareprodukter: NetGene2 (http://www.cbs.dtu.dk/services/NetGene2/) Og NNSplice (http://www.fruitfly.org/seq_tools/splice.html); 5 ‘ potensiell spleiseside ble også spådd å bli opprettet I L1CAM c.453G > t-mutasjon ved bruk av programvareprodukter (Figur S2). Resultatene viste at denne stille mutasjonen skapte et potensielt 5 ‘ spleisested 72 bp oppstrøms fra det normale exon 6 / intron 6 spleisestedet (Figur 2a). Hvis dette er tilfelle, kan vi finne lengdeendringen AV L1CAM messenger RNA (mRNA) mellom I: 2 OG II:5 (Figur 2a). RT-PCR ble utført ved hjelp av primere designet for å forsterke eksoner 4-6 I L1CAM mRNA. Faktisk viste resultatene et kort bånd av trunkering i føtal cDNA PCR (II:5), mens bandet forsterket FRA L1CAM mRNA inneholdt det forventede lange bandet i ektemann cDNA PCR (I:1) og lange / korte band i den gravide kvinnen cDNA PCR(I:2) (Figur 2B). Direkte sekvensering av det forsterkede fragmentet viste at slettingen involverte de siste 72 bp av exon 5 i mannlig føtal cDNA(kvinnen var bærer) (Figur 2c). Vi har de avgjørende patogene bevisene.
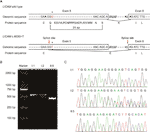
Figur 2 (A) Skjematisk representasjon av exon 5, intron 6 og exon 6 organisasjon I L1CAM. (B) RT-PCR analyse av eksoner 5 og 6 av l1cam cDNA fra perifert blod mononukleære celler (PMBCs) og ledningen blod mononukleære celler (CBMCs). Agarose gel elektroforese AV RT-PCR-produkter generert fra I: 1 (ektemann), I: 2 (gravid kvinne) OG II:5 (foster). (C) Sekvensanalyse AV RT-PCR-produktet fra pmbcs av paret og CBMCs av fosteret.
denne stille mutasjonen resulterte i 24 aminosyrer AV L1CAM protein (rester 151-174); Lys (K) ble erstattet Av Glu (E) ved kodon 175 (Figur 2a). Det var justering av flere L1CAM proteinsekvenser over flere arter og bevaring av de manglende aminosyrene I L1CAM over pattedyr: Homo sapiens, Pan troglodytes ,Bim taurus, Mus musculus og Rattus norvegicus (Figur 3a). Wild-type og c. 453G > T spleising mutasjon L1CAM proteiner ble spådd av programvaren CPHmodels – 3.2 Server (http://www.cbs.dtu.dk/services/CPHmodels/) (Figur 3B). Immunoglobulin-lignende (Ig-lignende) domene 2 (rester 134-230) av vill-type og skjøting mutasjon L1CAM proteiner er vist I Figur 3C. L1CAM c.453g > T skjøting mutasjon endret proteinstrukturen, spesielt Ig-lignende domene 2
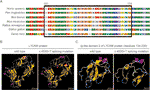
Figur 3 (A) Justering av flere L1CAM protein sekvenser på tvers av arter. L1CAM c.453G > t resulterte i at 24 aminosyrer AV L1CAM-protein (rester 151-174) manglet i den konserverte aminosyreregionen hos forskjellige arter. Den svarte kolonnen viser de manglende aminosyrene. (B) strukturer av vill-type og c. 453G > T skjøting mutasjon L1CAM protein som spådd av programvaren CPHmodels – 3.2 Server. (C) strukturer av immunglobulin-lignende (Ig-lignende) domene 2 (rester 134-230) av vill – type og skjøting mutasjon L1CAM protein.
Diskusjon
Stille mutasjoner ble ofte oppdaget AV WES, men utilstrekkelig oppmerksomhet har blitt betalt, noe som førte til utelatelse Av DMs. I denne studien ansatt VI WES for å utforske den genetiske årsaken til En Kinesisk familie med hydrocephalus, men fant bare en ny stille mutasjon I L1CAM, noe som tvang OSS til å foreta en videre analyse. Heldigvis viste vi at den stille mutasjonen skapte et nytt 5 ‘ splice-nettsted og var EN DM.
Mutasjoner I L1CAM kan forårsake en x-bundet L1 sykdom, men kliniske symptomer er variable; mutasjoner produserer uventede fenotyper. I studien er de fem lidende fostrene alle menn, noe som stemmer overens med et arvemønster. Fosterets ultralyd og MR viser en typisk l1 sykdom, inkludert XLH og agenesis av corpus callosum. Det forbedrer vår forståelse av genotype-fenotype korrelasjon AV L1CAM.
L1CAM c.453g > T (S.Gly151 =) ble opprinnelig antatt å ikke ha noen effekt på proteinsekvensen. Men andre tause mutasjoner, c. 924C > T (P. Gly308 =) og c.645c > T (P.Gly215 = ), I l1cam genet har blitt rapportert Å Være DMs (Du et al., 1998; Vos et al., 2010). C.924C > t-mutasjon resulterte i aktivering av et nytt spleisested 69 bp 5 ’til det normale exon 8 / intron 8 donor spleisestedet, og det har blitt erklært som et» sykdomsfremkallende » sted for hydrocephalus (Du Et al., 1998). For c.645c > T I L1CAM, 51 bp ble slettet med aktivering av en ny exon 6 / intron 6 donor splice (Vos et al., 2010). Vår nåværende studie var lik; mutasjonen av c. 453G > T skapte et potensielt 5 ‘ spleisested oppstrøms fra det normale exon 5 / intron 5 spleisestedet. Alle disse stille mutasjoner opprettet nye donor splice steder, noe som resulterer i exon blir hoppet over. Det minnet oss om å være oppmerksom på disse stille mutasjonene, som kan påvirke spleising av proteiner.
SOM et transmembrant glykoprotein og et medlem av immunglobulin-superfamilien av celleadhesjonsmolekyler, KAN l1cam-proteinet interagere på celleoverflaten med en rekke forskjellige glykoproteiner, og homofil binding er sannsynligvis den viktigste interaksjonsmåten (Wei Og Ryu, 2012). Studiene på krystallstrukturen av ig-lignende domener 1-4 i nevrofascin antydet at mange patologiske l1-mutasjoner påvirker konserverte aminosyrerester innenfor disse domenene og forstyrrer homofile interaksjoner (Liu et al., 2011), spesielt som verifisert av funksjonen forskning Av Ig-lignende domene 2 (Zhao et al., 1998). I vår studie spekulerte VI på AT L1CAM c.453g > t endret Ig-lignende domene 2 i den ekstracellulære delen AV l1cam-proteinet, noe som førte til unormal ekstracellulær interaksjon, og unnlot å starte initiering nedstrøms signalveien. En videre studie dedikert til massespektrometrien til DENNE l1cam-varianten vil avklare spesifikt hvilket molekylært ensemble som produseres i cellen.
i sammendraget, gjennom WES, rapporterte vi en ny stille mutasjon c.453g > T I L1CAM som produserer et 5 ‘ splice nettsted ansvarlig for hydrocephalus. Denne unormale proteinvarianten ble spådd å endre ig-lignende domene 2, noe som kan påvirke L1CAM-protein-homofil binding. I tillegg utførte vi prenatal genetisk diagnose for den gravide kvinnen som rapporterte fem kontinuerlige graviditeter med hydrocephalus. I mellomtiden foreslo det at noen stille mutasjoner oppdaget I WES ikke bør ignoreres; spleising spådommer om disse mutasjonene var nødvendige. Det ga et nytt genetisk grunnlag for prenatal diagnose og preimplantasjon prenatal diagnose av hydrocephalus.
Datatilgjengelighet
Offentlig tilgjengelige datasett ble analysert i denne studien. Disse dataene finner du her: GSE133063 (https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE133063).
Etikkerklæring
studiene som involverte menneskelige deltakere ble gjennomgått og godkjent av Review Board Of The Women ‘ S Hospital, School Of Medicine, Zhejiang University I Kina. Skriftlig informert samtykke til å delta i denne studien ble gitt av deltakerens verge / pårørende. Skriftlig informert samtykke ble innhentet fra den enkelte(e), og mindreårige (e) verge/pårørende, for publisering av eventuelle potensielt identifiserbare bilder eller data inkludert i denne artikkelen.
Forfatterbidrag
ys, YLi, MC, YLu, YQ og YY gjennomførte eksperimenter. YS utarbeidet tallene. MC og YLi analyserte WES-dataene. YLu og YQ utførte karyotypeanalyse og SNP array. Åå rekrutterte prøver. HL og FL gitt imaging undersøkelser. YS og MD skrev manuskriptet. Alle forfattere leste og godkjente det endelige manuskriptet.
Finansiering
denne studien ble støttet Av National Natural Science Foundation Of China (Grant No. 81801441), Det Viktigste forsknings-Og Utviklingsprogrammet I Zhejiang-provinsen (Grant No. 2019c03025), Kinas Nasjonale Nøkkelforsknings-Og Utviklingsprogram (Grant No. 2016yfc1000703), Og Medical Scientific Research Foundation Of Zhejiang-Provinsen (Grant No. 2014kya246).
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Bekreftelser
vi takker pasientene som deltok i denne undersøkelsen. Vi takker Dr. Jiong Gao (BGI Genomics, Bgi-Shenzhen, Shenzhen 518083, Kina) for hans hjelp under utarbeidelsen av dette manuskriptet.
Supplerende Materiale
Supplerende Materiale for denne artikkelen kan bli funnet online på: https://www.frontiersin.org/articles/10.3389/fgene.2019.00817/full#supplementary-material
Figur S1 / Analytisk strategi for å finne sannsynlig patogen variant identifikasjon AV WES.
Figur S2 / Donor splice nettsteder spådd Av NetGene2 Og NNSplice.
Tabell S1 / liste over varianter gjennom screening av variantfrekvenser, mutasjonsstatus og arvemodus.
Tabell S2 / Liste over hydrocephalusassosierte gener (Eksport FOR HP: 0000238).
Du, Yz, Dickerson, C., Aylsworth, A. S., Schwartz, C. E. (1998). En stille mutasjon, C924T (G308G), i l1cam genet resulterer I X koblet hydrocephalus (HSAS). J. Med. Genet. 35 (6), 456–462. doi: 10.1136 / jmg.35.6.456
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Itoh, K., Fushiki, S. (2015). Rollen Av L1cam i murine kortikogenese, og patogenesen av hydrocephalus. Pathol. Int. 65 (2), 58–66. doi: 10.1111 / pin.12245
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Li, H., Durbin, R. (2009). Rask og nøyaktig kort lese justering Med Burrows-Wheeler transform. Bioinformatikk 25 (14), 1754-1760. doi: 10.1093 / bioinformatikk / btp324
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Liu, H., Focia, P. J., Han, X. (2011). Homofil adhesjonsmekanisme av nevrofascin, et medlem Av l1-familien av nevrale celleadhesjonsmolekyler. J. Biol. Chem. 286 (1), 797–805. doi: 10.1074 / jbc.M110.180281
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
A., Hanna, M., Banks, E., Sivachenko, A., Cibulskis, K., Kernytsky, A., et al. (2010). Genome Analysis Toolkit: Et MapReduce-rammeverk for analyse av NESTE generasjons DNA-sekvenseringsdata. Genom Res. 20 (9), 1297-1303. doi: 10.1101 / gr.107524.110
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Richards, S., Aziz, N., Bale, S., Bick, D., Das, S., Gastier-Foster, J., et al. (2015). Standarder og retningslinjer for tolkning av sekvensvarianter: en felles konsensusanbefaling fra American College Of Medical Genetics and Genomics og Association for Molecular Pathology. Genet. Med. 17 (5), 405–424. doi: 10.1038 / gim.2015.30
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Vos, Y. J., De Walle, H. E. K., Bos, K. K., Stegeman, J. A., Berge, A. M., Bruining, M., et al. (2010). Genotype-fenotype korrelasjoner I L1 syndrom: en veiledning for genetisk rådgivning og mutasjonsanalyse. J. Med. Genet. 47 (3), 169–175. doi: 10.1136 / jmg.2009.071688
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Wei, C. H., Ryu, S. E. (2012). Homofil interaksjon Av l1-familien av celleadhesjonsmolekyler. Exp. Mol. Med. 44 (7), 413–423. doi: 10.3858 / emm.2012.44.7.050
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
Weller, S., Gartner, J. (2001). Genetiske og kliniske aspekter Ved x-bundet hydrocephalus (L1 sykdom): mutasjoner I l1cam genet. Hum. Mutat. 18 (1), 1–12. doi: 10.1002 / humu.1144
PubMed Abstract | CrossRef Full Text | Google Scholar
Zhao, X., Yip, P. M., Siu, C. H. (1998). Identification of a homophilic binding site in immunoglobulin-like domain 2 of the cell adhesion molecule L1. J. Neurochem. 71 (3), 960–971 doi: 10.1046/j.1471-4159.1998.71030960.x.
PubMed Abstract | CrossRef Full Text | Google Scholar