Doseringsform: aerosol, skum
Medisinsk vurdert Av Drugs.com. Sist oppdatert Sep 1, 2019.
- Oversikt
- Bivirkninger
- Dosering
- Graviditet
- Mer
- Indikasjoner Og Bruk For Ketokonazol Skum
- Ketokonazol Skumdosering Og Administrasjon
- Doseringsformer Og Styrker
- Kontraindikasjoner
- Advarsler Og Forsiktighetsregler
- Kontakt Sensibilisering
- Brennbart Innhold
- Systemiske Effekter
- Bivirkninger
- Kliniske Studier Opplever
- Hudsikkerhetsstudier
- Erfaring Etter Markedsføring
- BRUK i SPESIFIKKE POPULASJONER
- Graviditet
- Amming
- Kvinner Og Menn Av Reproduksjonspotensial
- Pediatrisk Bruk
- Geriatrisk Bruk
- Ketokonazol Skum Beskrivelse
- Ketokonazol Skum-Klinisk Farmakologi
- Virkningsmekanisme
- Farmakodynamikk
- Farmakokinetikk
- Mikrobiologi
- Ikke-Klinisk Toksikologi
- Karsinogenese, Mutagenese, Nedsatt Fertilitet
- Kliniske Studier
- Hvordan Levert / Lagring Og Håndtering
- Informasjon Om Pasientrådgivning
- Bruksanvisning
- PASIENTINFORMASJON
- PAKKE/ETIKETT HOVEDSKJERMPANEL – KARTONG
- mer om ketokonazol aktuell)
- Consumer resources
- Professional resources
- Related treatment guides
Indikasjoner Og Bruk For Ketokonazol Skum
Ketokonazol Skum, 2% er indikert for aktuell behandling av seborrheisk dermatitt hos immunkompetente pasienter 12 år Og Eldre.
Bruksbegrensninger
Sikkerhet og effekt Av Ketokonazolskum, 2% for behandling av soppinfeksjoner er ikke fastslått.
Ketokonazol Skumdosering Og Administrasjon
Ketokonazol Skum, 2% bør påføres det berørte området (e) to ganger daglig i fire uker.
Hold beholderen oppreist, og dispenser Ketokonazolskum, 2% i lokket på boksen eller annen kjølig overflate i en mengde som er tilstrekkelig til å dekke de berørte områdene. Dispensering direkte på hender anbefales ikke, da skummet begynner å smelte umiddelbart ved kontakt med varm hud. Plukk opp små mengder Ketokonazolskum, 2% med fingertuppene, og masser forsiktig inn i det berørte området (e) til skummet forsvinner. For hårbærende områder, del håret, Slik At Ketokonazolskum, 2% kan påføres direkte på huden (i stedet for på håret).
Unngå kontakt med øynene og andre slimhinner. Ketokonazolskum, 2% er ikke til oftalmisk, oral eller intravaginal bruk.
Doseringsformer Og Styrker
Ketokonazol Skum, 2% inneholder 20 mg ketokonazol, USP per gram, leveres i 50 g og 100 g beholdere.
Kontraindikasjoner
Ingen.
Advarsler Og Forsiktighetsregler
Kontakt Sensibilisering
Ketokonazol Skum, 2% kan føre til kontakt sensibilisering, inkludert fotoallergenicity.
Brennbart Innhold
Innholdet Av Ketokonazolskum, 2% inkluderer alkohol og propan / butan, som er brannfarlige. Unngå brann, flamme og / eller røyking under og umiddelbart etter påføring. Ikke stikk hull i og/eller brenn beholderne. Utsett ikke beholderne for varme og / eller lagring ved temperaturer over 120°F (49°C).
Systemiske Effekter
Hepatitt Er sett ved oralt administrert ketokonazol (1:10 000 rapportert insidens). Senket testosteron og ACTH-indusert kortikosteroid serumnivåer har blitt sett med høye doser av oralt administrert ketokonazol. Disse effektene er ikke sett med topisk ketokonazol.
Bivirkninger
Kliniske Studier Opplever
fordi kliniske studier utføres under svært varierende forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke direkte sammenlignes med rater i kliniske studier av et annet legemiddel, og kan ikke gjenspeile ratene observert i praksis. Bivirkningsinformasjonen fra kliniske studier gir imidlertid grunnlag for å identifisere bivirkninger som synes å være relatert til narkotikabruk og for tilnærmet priser.
sikkerhetsdataene presentert I Tabell 1 reflekterer eksponering For Ketokonazolskum, 2% hos 672 personer, 12 år og eldre med seborrheisk dermatitt. Emner brukt Ketokonazol Skum, 2% eller kjøretøy skum to ganger daglig i 4 uker til berørte områder i ansiktet, hodebunnen og / eller brystet. Bivirkninger hos > 1% av forsøkspersonene er presentert I Tabell 1.
Tabell 1: Bivirkninger Rapportert av >1% Av Pasientene I Kliniske Studier
|
Bivirkninger |
Ketokonazolskum, 2% N = 672 n (%) |
Kjøretøy Skum N=497 n (%) |
|
Personer med En Bivirkning |
188 (28%) |
122 (25%) |
|
brennende Påføringsstedet |
67 (10%) |
49 (10%) |
|
Reaksjon på Påføringsstedet |
41 (6%) |
24 (5%) |
Reaksjoner på Applikasjonsstedet som ble rapportert hos < 1% av pasientene var tørrhet, erytem, irritasjon, parestesi, kløe, utslett og varme.
Hudsikkerhetsstudier
i en fotoallergenitetsstudie hadde 9 av 53 forsøkspersoner (17%) reaksjoner i smitteperioden ved både bestrålede og ikke-bestrålede steder behandlet Med Ketokonazolskum, 2%. Ketokonazol Skum, 2% kan forårsake kontakt sensibilisering.
Erfaring Etter Markedsføring
følgende bivirkninger er identifisert ved bruk Av Ketokonazolskum etter markedsføring, 2%:
Gastrointestinale sykdommer: Keilitt
Generelle lidelser og reaksjoner på administrasjonsstedet: smerter på påføringsstedet og brannskader på påføringsstedet
Hud-og underhudssykdommer: Brennende følelse i huden og erytem
fordi disse hendelsene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å estimere frekvensen på en pålitelig måte eller etablere en årsakssammenheng med legemiddeleksponering.
BRUK i SPESIFIKKE POPULASJONER
Graviditet
Risikosammendrag
Det finnes ingen tilgjengelige Data På Ketokonazolskum, 2% bruk hos gravide kvinner for å identifisere en legemiddelassosiert risiko for alvorlige fødselsskader, spontanabort eller uheldige utfall hos mor eller foster. Det er ikke utført reproduksjonsstudier på dyr med Ketokonazolskum, 2%. I reproduksjonsstudier på dyr med drektige mus, rotter og kaniner ble det observert både embryotoksiske og utviklingsmessige effekter (strukturelle abnormiteter) etter oral dosering av ketokonazol under organogenese. Forutsatt tilsvarende systemisk absorpsjon av topikale og orale ketokonazol-doser og Et Ketokonazolskum, ble 2% maksimal anbefalt human dose (MRHD) på 8 gram (tilsvarende 160 mg ketokonazol), embryotoksiske effekter observert ved 0,8 til 2,4 ganger MRHD og utviklingseffekter ble observert ved 4.8 ganger MRHD .
bakgrunnsrisikoen for store fødselsskader og spontanabort for den indikerte populasjonen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uønskede utfall. I DEN AMERIKANSKE befolkningen er den estimerte bakgrunnsrisikoen for store fødselsskader og abort i klinisk anerkjente graviditeter henholdsvis 2 til 4% og 15 til 20%.
Data
Dyredata
dyrenes multipler av beregninger for human eksponering er basert på sammenligninger av kroppsoverflate (bsa) av orale doser administrert til dyr og Et Ketokonazolskum, 2% maksimal anbefalt human dose (MRHD) på 8 gram (tilsvarende 2,67 mg ketokonazol/kg/dag for en 60 kg person eller 98,8 mg ketokonazol/m2/dag).
Studier Av Embryoføtal utvikling er utført på mus, rotter og kaniner med oralt administrert ketokonazol. Når det ble gitt oralt til mus på svangerskapsdagen 6 til 18 (som dekker organogeneseperioden), var ketokonazol embryotoksisk (25 mg/kg og høyere; 0,8 ganger MRHD basert på bsa-sammenligninger) med høy forekomst av resorpsjoner, økt antall dødfødsler og forsinket fødsel. Forsinkelser i modning ble også observert. Det var ingen tegn på maternal toksisitet eller misdannelser ved opptil 50 mg / kg(1,5 ganger MRHD basert PÅ bsa-sammenligninger). Ingen behandlingsrelaterte utviklingseffekter ble observert ved 10 mg / kg (0,3 ganger MRHD basert PÅ bsa-sammenligninger).
i nærvær av maternal toksisitet hos rotter var oralt administrert ketokonazol både embryotoksisk (40 mg / kg og høyere; 2,4 GANGER MRHD basert PÅ bsa-sammenligninger), inkludert økte resorberte fostre og dødfødsler, og teratogene (80 mg / kg og høyere; 4,8 ganger MRHD basert på bsa-sammenligninger), inkludert syndactylia, oligodactylia, vinket ribbe og ganespalte. I tillegg var 100 mg/kg (6 GANGER MRHD basert PÅ bsa-sammenligninger) ketokonazol oralt administrert på en enkelt dag i løpet av svangerskapet (svangerskapsdager 9 til 12) embryotoksisk (økte resorpsjoner). Samme orale dose gitt på drektighetsdag 12, 13, 14 eller 15 induserte eksterne misdannelser inkludert ganespalte, mikromelia og digitale anomalier (brachydactyly, ectrodactyly, syndactyly).
hos drektige kaniner oralt administrert ketokonazol ble det observert embryotoksisitet (økt resorpsjon) ved 10 mg/kg (1,2 GANGER MRHD basert PÅ bsa-sammenligninger) og høyere og økt forekomst av skjelettabnormaliteter ble observert ved 40 mg / kg (4,8 ganger MRHD basert på bsa-sammenligninger).
Amming
Risikosammendrag
det finnes ingen tilgjengelig informasjon om tilstedeværelse av ketokonazol i morsmelk hos mennesker, effekter på det diende barnet eller effekter på melkeproduksjonen etter lokal Påføring Av Ketokonazolskum, 2% hos kvinner som ammer. I dyrestudier ble ketokonazol funnet i melk etter oral administrasjon. Utviklings-og helsemessige fordeler ved amming bør vurderes sammen med mors kliniske behov For Ketokonazolskum, 2% og eventuelle potensielle bivirkninger på det ammende spedbarnet Fra Ketokonazolskum, 2% eller fra den underliggende maternelle tilstanden.
Kvinner Og Menn Av Reproduksjonspotensial
Infertilitet
i fertilitetsstudier på dyr hos rotter og hunder resulterte administrering av orale doser ketokonazol mellom 3-dagers og 3-måneders perioder i infertilitet som var reversibel .
Pediatrisk Bruk
sikkerhet Og effekt Av Ketokonazol Skum, 2% hos pediatriske pasienter under 12 år er ikke fastslått.
av de 672 pasientene som ble behandlet Med Ketokonazolskum, var 2% i de kliniske studiene 44 (7%) fra 12 til 17 år. .
Geriatrisk Bruk
av de 672 forsøkspersonene som ble behandlet Med Ketokonazolskum, var 2% i de kliniske studiene 107 (16%) 65 år og eldre.
Kliniske studier Av Ketokonazolskum, 2% inkluderte ikke tilstrekkelig antall personer i alderen 65 og over for å avgjøre om de reagerer annerledes enn yngre personer.
Ketokonazol Skum Beskrivelse
Ketokonazol Skum, 2% inneholder 2% ketokonazol USP, en soppdrepende middel, i en thermolabile hydroetanolic skum for lokal applikasjon.
det kjemiske navnet for ketokonazol er piperazin, 1-acetyl-4-metoksy] fenyl] -, cis – med molekylformelen C26H28CI2N4O4 og en molekylvekt på 531,43.
følgende er den kjemiske strukturen:
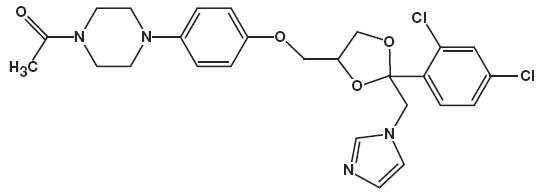
Ketokonazolskum, 2% inneholder 20 mg ketokonazol per gram i et termolabilt hydroetanolisk skumkjøretøy bestående av cetylalkohol, sitronsyre, etanol (denaturert med tert-butylalkohol og brucinsulfat) 58%, polysorbat 60, kaliumsitrat, propylenglykol, renset vann og stearylalkohol trykket med et hydrokarbon (propan/butan) drivmiddel.
Ketokonazol Skum-Klinisk Farmakologi
Virkningsmekanisme
virkningsmekanismen av ketokonazol ved behandling av seborrheisk dermatitt er ikke kjent.
Farmakodynamikk
farmakodynamikken Til Ketokonazolskum, 2%, er ikke fastslått.
Farmakokinetikk
i en biotilgjengelighetsstudie påførte 12 personer med moderat til alvorlig seborrheisk dermatitt 3 g Ketokonazolskum, 2% to ganger daglig i 4 uker. Sirkulerende plasmanivåer av ketokonazol var < 6 ng/ mL for de fleste forsøkspersonene (75%), med et maksimumsnivå på 11 ng/mL observert hos en forsøksperson.
Mikrobiologi
Ketokonazol er Et soppdrepende middel som hemmer in vitro-syntesen av ergosterol, en nøkkelsterol i cellemembranen Til Malassezia furfur. Den kliniske betydningen av antifungal aktivitet ved behandling av seborrheisk dermatitt er ikke kjent.
Ikke-Klinisk Toksikologi
Karsinogenese, Mutagenese, Nedsatt Fertilitet
Langtidsstudier på dyr er ikke utført for å evaluere Det karsinogene Eller foto-karsinogene potensialet Av Ketokonazolskum, 2%.
i orale karsinogenitetsstudier med mus (18 måneder) og rotter (24 måneder) ved dosenivåer på 5, 20 og 80 mg/kg/dag var ketokonazol ikke karsinogent. Den høye dosen i disse studiene var omtrent 2,4 til 4,8 ganger MRHD basert PÅ bsa-sammenligninger. I en bakteriell revers mutasjonsanalyse uttrykte ketokonazol ikke noe mutagent potensial. I tre in vivo-analyser (søsterkromatidutveksling hos mennesker, dominerende dødelige og mikronukleustester hos mus) viste ketokonazol ikke noe gentoksisk potensial.
i fertilitetsstudier på dyr svekket oral ketokonazol både mannlig og kvinnelig fertilitet hos rotter på en dose-og varighetsavhengig måte. Hos kvinner hadde orale doser på opptil 40 mg/kg (2,4 GANGER MRHD basert PÅ bsa-sammenligninger) ingen effekt på fertilitet, mens doser på 75 mg/kg (4,5 ganger MRHD basert på bsa-sammenligninger) og høyere reduserte graviditetsraten og antall implantasjonssteder. Hos hannrotter reduserte oral dosering med 200 mg/kg/dag (12 GANGER MRHD basert PÅ bsa-sammenligninger) i tre dager fertiliteten og 400 mg/kg/dag (24 ganger MRHD basert på bsa-sammenligninger) i tre dager medførte et fullstendig tap av fertilitet. Ved administrering over lengre tid (opptil 3 måneder) ble det observert redusert fertilitet hos hannrotter ved doser så lave som 24 mg/kg/dag (1,4 GANGER MRHD basert PÅ bsa-sammenligninger). Hos mannlige beagle hunder, en oral dose på 25 mg/kg/dag ketokonazol i opptil 4 uker (5.2 GANGER MRHD basert PÅ bsa sammenligninger) resulterte i redusert sperm motilitet, redusert sædkvalitet, økt unormal sperm og atrofi av testiklene. Disse effektene ble reversert etter seponering av behandlingen.
Kliniske Studier
sikkerhet Og effekt Av Ketokonazolskum, 2%, ble evaluert i en randomisert, dobbeltblind, kjøretøykontrollert studie hos personer 12 år og eldre med mild til alvorlig seborrheisk dermatitt. I forsøket fikk 427 personer Ketokonazolskum, 2% og 420 personer mottok kjøretøyskum. Emner brukt Ketokonazol Skum, 2% eller kjøretøy skum to ganger daglig i 4 uker til berørte områder i ansiktet, hodebunnen og / eller brystet. Den totale alvorlighetsgraden av sykdommen i form av erytem, skalering og indurasjon ble vurdert Ved Baseline og uke 4 på EN 5-punkts Utprøvers Static Global Assessment (ISGA) skala.
behandlingssuksess ble definert som Å oppnå En Uke 4 (behandlingsslutt) ISGA-score på 0 (klar) eller 1 (flertallet av lesjonene har individuelle skår for skalering, erytem og indurasjon som gjennomsnitt 1 ) og minst to grader av forbedring fra baseline. Resultatene er presentert I Tabell 2. Databasen var ikke stor nok til å vurdere om det var forskjeller i effekter i alder, kjønn eller rase undergrupper.
Tabell 2: Effektresultater
|
Antall Emner |
Ketokonazolskum, 2% N = 427 n (%) |
Kjøretøy Skum N = 420 n (%) |
|
Emner Som Oppnår Behandlingssuksess |
239 (56%) |
176 (42%) |
Hvordan Levert / Lagring Og Håndtering
Ketokonazol Skum, 2% inneholder 20 mg ketokonazol, USP per gram. Det termolabile hydroetanolske skummet er tilgjengelig som følger:
NDC 45802-532-32
50 g aluminiumskanne
NDC 45802-532-33
100 g aluminiumskanne
Lagre ved 20° til 25°C (68° til 77 hryvnias f). .
må ikke oppbevares i kjøleskap.
Innholdet er brannfarlig. Utsett ikke beholderne for varme og / eller lagring ved temperaturer over 49°C (120°F). Må ikke oppbevares i direkte sollys.
Innhold under trykk. Ikke stikk hull i og/eller brenn beholderen.
Oppbevares utilgjengelig for barn.
Informasjon Om Pasientrådgivning
Se FDA-godkjent pasientmerking(Pakningsvedlegg For Pasient).
Instruere pasienter på en riktig bruk Av Ketokonazol Skum, 2%.
* Unngå brann, flamme og / eller røyking under og umiddelbart etter påføring. * Ikke bruk Ketokonazolskum, 2% direkte på hender. Påfør på en kjølig overflate, og påfør på de berørte områdene med fingertuppene. • Vask hendene etter påføring * Ketokonazolskum, 2% kan forårsake hudirritasjon (påføringsstedet brenner og/eller reaksjoner) • Be en pasient om å kontakte helsepersonell hvis applikasjonsområdet viser tegn på økt irritasjon og rapportere tegn på bivirkninger.
Laget I Israel
Produsert Av Perrigo
Yeruham, Israel
Distribuert Av
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
5K200RCJ3
Bruksanvisning
Ketokonazol Skum, 2%
Viktig Informasjon: Ketokonazol Skum, 2% er kun til bruk på huden. Ikke bruk Ketokonazol Skum, 2% i dine øyne, munn eller vagina.
Trinn 1: Fjern den klare hetten Fra Ketokonazolskummet, 2% boks.
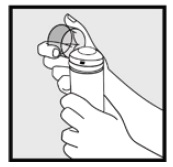
Trinn 2: Hold boksen oppreist og trykk fast på dysen for å dispensere Ketokonazolskum, 2% i den klare hetten. * Dispense Nok Ketokonazolskum, 2% for å dekke hele det berørte området(e).
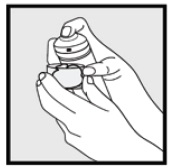
• hvis boksen virker varm eller skummet virker rennende, kjør boksen under kaldt vann.
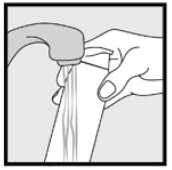
Trinn 3: Plukk opp små mengder Ketokonazolskum, 2% med fingertuppene og gni forsiktig skummet inn i det berørte området(e) til skummet forsvinner.
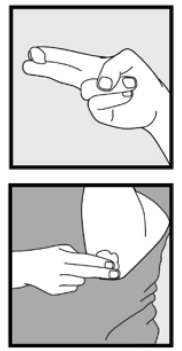
• hvis du behandler områder som hodebunnen, del håret slik At Ketokonazol Skum, 2% kan påføres direkte på huden.

Trinn 4: Vask hendene etter Påføring Av Ketokonazolskum, 2%. * Kast noe av det ubrukte legemidlet som er igjen i hetten.
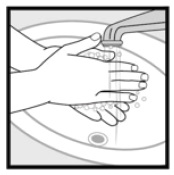
Hvordan skal Jeg lagre Ketokonazolskum, 2%? Hold Ketokonazol Skum, 2% og alle medisiner utilgjengelig for barn.
Denne Bruksanvisningen er godkjent av Us Food And Drug Administration.
Bare Rx
Laget I Israel
Produsert Av Perrigo
Yeruham, Israel
Distribuert Av
Perrigo®
Allegan, MI 49010
www.perrigo.com
Rev 08-18
PASIENTINFORMASJON
Ketokonazolskum, 2%
Viktig Informasjon: Ketokonazolskum, 2% er kun til bruk på huden. Ikke bruk Ketokonazol Skum, 2% i dine øyne, munn eller vagina.
Hva Er Ketokonazol Skum, 2%?
Ketokonazol Skum, 2% er en reseptbelagte medisiner som brukes på huden (aktuell) for å behandle seboreisk eksem hos personer 12 år og eldre med et normalt immunsystem.
Det er ikke kjent Om Ketokonazolskum, 2% er trygt og effektivt når det brukes til å behandle soppinfeksjoner.
Det er ikke kjent Om Ketokonazol Skum, 2% er trygt og effektivt hos barn under 12 år.
før Du bruker Ketokonazol Skum, 2%, fortelle helsepersonell om alle dine medisinske tilstander, inkludert hvis du:
• er gravid eller planlegger å bli gravid. Det er ikke kjent Om Ketokonazol Skum, 2% vil skade det ufødte barnet. * ammer eller planlegger å amme. Det er ikke kjent Om Ketokonazol Skum, 2% går over i morsmelk. Snakk med helsepersonell om den beste måten å mate barnet ditt under behandling Med Ketokonazolskum, 2%.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og over-the-counter medisiner, vitaminer og urte kosttilskudd.
hvordan skal Jeg bruke Ketokonazolskum, 2%?
• Bruk Ketokonazol Skum, 2% akkurat som helsepersonell forteller deg å bruke den. Se detaljert «Bruksanvisning» på slutten av dette pakningsvedlegget for veibeskrivelse om Hvordan du bruker Ketokonazolskum, 2% på riktig måte. * Påfør Ketokonazolskum, 2% til det berørte hudområdet(e) 2 ganger hver dag i 4 uker. Du bør bruke Nok Ketokonazolskum, 2% for å dekke hele det berørte området(e). * Snakk med helsepersonell hvis huden din ikke blir bedre etter 4 ukers Behandling Med Ketokonazolskum, 2%. * Dispense Ketokonazolskum, 2% direkte inn i lokket. Ikke dispensere Ketokonazol Skum, 2% direkte på hendene, fordi skummet vil begynne å smelte ved kontakt med varm hud. * Vask hendene etter Bruk Av Ketokonazolskum, 2%.
Hva skal jeg unngå mens Jeg bruker Ketokonazolskum, 2%?
• Ketokonazolskum, 2% er brannfarlig. Unngå brann, flammer eller røyking under Og rett etter At Du bruker Ketokonazol Skum, 2% på huden din. * Unngå Å få Ketokonazol Skum, 2% i eller i nærheten av øyne, munn, lepper eller vagina. Hvis Du får Ketokonazolskum, 2% på leppene eller i øynene, munnen eller skjeden, skyll godt med vann.
hva er de mulige bivirkningene Av Ketokonazol Skum, 2%?
Ketokonazolskum, 2% kan forårsake alvorlige bivirkninger, inkludert:
• hudirritasjon på applikasjonsområdet(e), inkludert hudreaksjoner forårsaket av lyseksponering. Informer helsepersonell dersom du utvikler hudirritasjon under Behandling med Ketokonazolskum, 2%.
De vanligste bivirkningene Av Ketokonazolskum, 2% inkluderer brenning, tørrhet, rødhet, irritasjon, nummenhet, kløe, utslett og varme på applikasjonsstedet.
Dette er ikke alle mulige bivirkninger Av Ketokonazolskum, 2%.
Ring legen din for medisinske råd om bivirkninger. Du kan rapportere bivirkninger TIL FDA på 1-800-FDA-1088.
hvordan skal Jeg lagre Ketokonazol Skum, 2%?Generell informasjon om sikker Og effektiv Bruk Av Ketokonazolskum, 2%.
Legemidler er noen Ganger foreskrevet for andre formål enn de som er oppført i et pakningsvedlegg. Ikke Bruk Ketokonazolskum, 2% for en tilstand som det ikke var foreskrevet for. Ikke Gi Ketokonazolskum, 2% til andre mennesker, selv om de har de samme symptomene du har. Det kan skade dem. Du kan spørre apoteket eller helsepersonell for informasjon Om Ketokonazolskum, 2% som er skrevet for helsepersonell.
hva er ingrediensene I Ketokonazol Skum, 2%?
Aktiv ingrediens: ketokonazol
Inaktive Ingredienser: cetylalkohol, sitronsyre, etanol (denaturert med tert-butylalkohol og brucinsulfat) 58%, polysorbat 60, kaliumsitrat, propylenglykol, renset vann og stearylalkohol under trykk med et hydrokarbon (propan/butan) drivmiddel
for mer informasjon, ring Perrigo på 1-866-634-9120
dette pakningsvedlegget er godkjent av u. s. food and drug administration.
PAKKE/ETIKETT HOVEDSKJERMPANEL – KARTONG
Kun Rx
Ketokonazolskum, 2%
Kun Til Utvortes Bruk.
Ikke Til Oftalmisk, Oral Eller Intravaginal Bruk.
100 g

følgende bilde er en plassholder som representerer produktidentifikatoren som enten er festet eller trykt på legemiddeletiketten under emballasjeoperasjonen.

| KETOKONAZOL ketokonazol aerosol, skum |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
Etiketter-Perrigo New York Inc (078846912)
mer om ketokonazol aktuell)
- Bivirkninger
- Under Graviditet Eller Amming
- Doseringsinformasjon
- Sammenlign Alternativer
- Priser & Kuponger
- spansk
- 36 Anmeldelser
- legemiddelklasse: topical antifungals
Consumer resources
- Patient Information
- Ketoconazole Topical (Advanced Reading)
Professional resources
- Prescribing Information
- Ketoconazole (Topical) (Professional Patient Advice)
- Ketoconazole Cream (FDA)
- Ketoconazole Shampoo (FDA)
Other brands Nizoral Shampoo, Ketodan, Extina, Xolegel
Related treatment guides
- Seborrheic Dermatitis
- Cutaneous Candidiasis
- Androgenetic Alopecia
- Dandruff
- … + 4 mer
Medisinsk Ansvarsfraskrivelse