
på de flesta av dessa sidor har vi pratat om polymerer vars ryggradskedjor består mestadels av kolatomer, om inte helt av kolatomer. Dessa kallar vi organiska polymerer. Men nu ska vi lämna konventionen bakom och prata om några polymerer som inte har några kolatomer i ryggradskedjan. Dessa kallas, som om du inte kunde gissa, oorganiska polymerer. Här är en meny om oorganiska polymerer på denna sida för att hjälpa dig att navigera:
- silikoner Polysilaner Polygermaner och polystannaner Polypospahazenes
silikoner
du har säkert sett oorganiska polymerer tidigare, särskilt de som kallas silikoner. Silikoner är de vanligaste av de oorganiska polymererna. De ser ut så här:
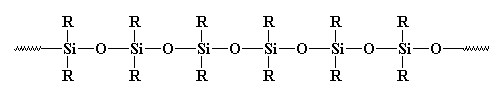
de borde verkligen kallas polysiloxaner. Bindningen mellan kisel och syre är mycket stark, men mycket flexibel. Så silikoner kan stå höga temperaturer utan att sönderdelas, men de har mycket låga glasövergångstemperaturer. Du har förmodligen sett gummi eller tätning av silikoner någonstansinnan.
Polysilaner
Låt oss ta en titt på elementet kisel för ett ögonblick. Du kan se att det är rätt under kol i det periodiska diagrammet. Som du kanske kommer ihåg har element i samma kolumn eller grupp i det periodiska diagrammet ofta mycket liknande egenskaper. Så, om KOL kan bilda långa polymerkedjor, bör kisel också kunna.
rätt?
höger. Det tog lång tid att få det att hända, men kiselatomer har gjorts till långa polymerkedjor. Det var på 1920-och 30-talet som kemister började räkna ut att organiska polymerer gjordes av långa kolkedjor, men allvarlig undersökning av polysilaner utfördes inte förrän i slutet av sjuttiotalet.
tidigare, 1949, ungefär samtidigt som författaren Kurt Vonnegut arbetade för PR-avdelningen vid General Electric, arbetade C. A. Burkhard i G. E.: s forsknings-och utvecklingsavdelning. Han uppfann en polysilan som heter polydimetylsilan, men det var inte mycket bra för någonting. Det såg ut så här:
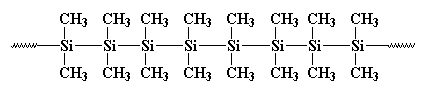
det bildade kristaller som var så starka att ingenting kunde lösa upp dem. Burkhard försökte värma det, men det skulle inte smälta under 250oc, när det sönderdelades, utan att smälta. Det gjorde polydimetylsilan ganska mycket värdelös. Han gjorde det genom att reagera natriummetall med diklorodimetylsilan så här:
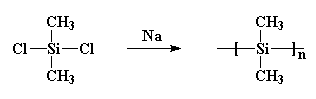
Detta är viktigt, för på sjuttiotalet fick vissa forskare uppfattningen att de skulle göra små ringar av kiselatomer. Så omedvetet gjorde något liknande vad Burkhard hade gjort. De reagerade natriummetall med diklorodimetylsilan, men de tillsatte också lite diklormetylfenylsilan till bryggan. Och gissa vad som hände! Jag ska ge dig en ledtråd: de fick inte de ringar de ville ha. Vad de fick var en sampolymer, så här:
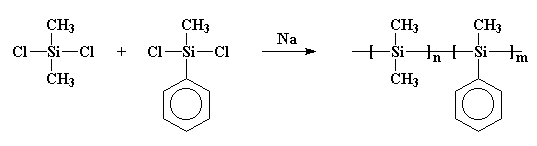
kanske är den polymeren tydligare ritad så här:
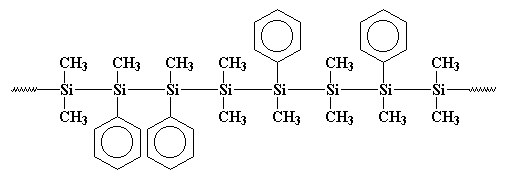
du ser, dessa fenylgrupper kommer i vägen när polymeren försöker kristallisera, så det är inte lika kristallint som polydimetylsilan. Det betyder att det är lösligt och kan bearbetas och spelas med och studeras.
så vad är dessa bra för? Polysilaner är intressanta eftersom de kan leda elektricitet. Inte lika bra som koppar, märk väl, men mycket bättre än du förväntar dig för en polymer, och värt att undersöka. De är också mycket värmebeständiga, nästan upp till 300 oC, men om du värmer dem mycket högre kan du göra kiselkarbid av dem, vilket är ett användbart slipmedel.
Polygermaner och Polystannaner
Okej, så om kisel kan göra långa polymerkedjor, hur är det med andra element i grupp IV? Kan du göra polymerer av germanium? Du skulle bättre tro att du kan! Inte bara kan du göra polymerkedjor av germanium, men du kan till och med göra en polymerkedja av tennatomer. Dessa polymerer kallas polygermaner respektive polystannaner.

Polystannaner är unika och snygga och underbara och fantastiska eftersom de är de enda kända polymererna med ryggraden helt gjorda av metallatomer. Liksom polysilaner studeras polygermaner och polystannaner för användning som elektriska ledare.
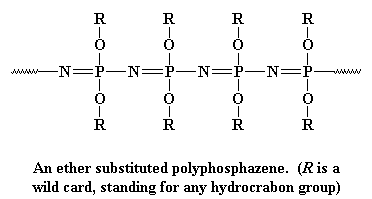
denna ryggrad är mycket flexibel, som polysiloxan-ryggradskedjan, så polyfosfazener gör bra elastomerer. De är också mycket bra elektriska isolatorer. Polyfosfazener tillverkas i två steg:
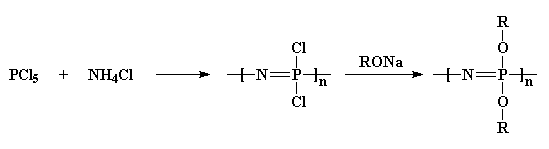
först tar vi fosforpentaklorid och reagerar den med ammoniumklorid för att få en klorerad polymer. Sedan behandlar vi det med ett alkoholnatriumsalt, och det ger oss en etersubstituerad polyfosfazen.
Tja, det räcker med detta fascinerande ämne för nu. Även om det kan finnas nya och spännande oorganiska polymerer som har gjorts (forskningsmarscher på, Naturligtvis), kan vi inte täcka allt på dessa sidor. Och glöm inte, det finns intressanta kombinationer av heteroatomer (icke-kolatomer) med kolatomer i en mängd olika polymerben och hängande grupper. Dessa kan kallas ”semi-oorganiska”, även om det kan vara för artificiellt för vissa.
 |
återgå till nivå tre katalog |
 |
återgå toMacrogalleria katalog |