Le syndrome auto-immun de l’insuline (SAI) est l’une des principales causes d’hypoglycémie dans la population japonaise.1 En Inde, qui compte plus de 1 milliard d’habitants, seuls 28 cas d’IAS ont été signalés à ce jour, à notre connaissance.L’IAS 2-10 se caractérise par une hypoglycémie hyperinsulinémique – des titres insulinoanticorps élevés sans exposition préalable à l’insuline exogène. La plupart des cas d’IAS sont auto-limitatifs. Ici, nous rapportons notre expérience avec deux cas de cette maladie rare.
Cas 1
Un Indien de 48 ans s’est présenté à notre clinique endocrinienne avec des épisodes répétés d’hypoglycémie sévère au cours des 4 derniers mois. Ces épisodes se sont produits 3 à 4 heures après les repas et ont été caractérisés par des symptômes de faim accrue, de vertiges, de palpitations, de tremblements et de diaphorèse. Les symptômes ont été inversés par le patient mangeant un repas à base de glucides. Le patient a obtenu un glucomètre et ses lectures de glycémie au cours des épisodes symptomatiques ont varié entre 30 et 40 mg / dL. Il n’y avait pas d’antécédents d’hypoglycémie à jeun.
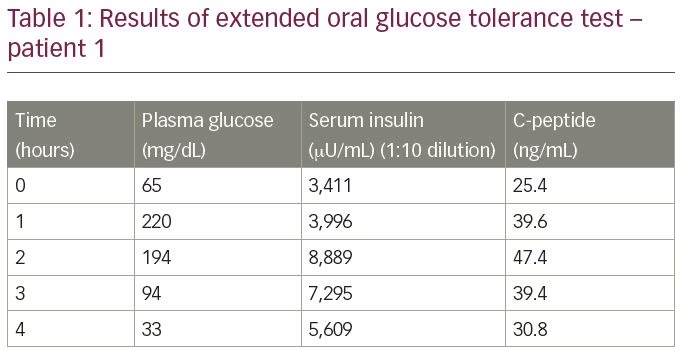
Le patient n’était pas diabétique et n’avait aucun antécédent d’exposition à l’insuline, aux sécrétagogues d’insuline ou à tout médicament connu pour précipiter l’hypoglycémie. Il a été soumis à un test oral prolongé de tolérance au glucose, dont les résultats sont résumés dans le tableau 1. Le résultat du test a révélé une glycémie de 33 mg / dL, avec une insuline sérique correspondante de 5 609 µU / mL (plage normale
– 9,2–138,9 µU / mL) et un peptide C sérique de 30,9 ng / mL (plage normale 1,1-4.4 ng/mL), mesurée par dosage par électrochimiluminescence (Roche Diagnostics, Rotkreuz, Suisse). Le rapport molaire insuline/peptide C était de 3:8 (plus de 1). Les valeurs de laboratoire ont soulevé une suspicion d’IAS. Pour confirmer le diagnostic, les titres d’anticorps anti-insuline ont été mesurés par immunodosage enzymatique; le taux était supérieur à 300 U / mL (plage normale < 12 U / mL). L’analyse d’autres autoanticorps (anticorps antinucléaire, anticorps anti-ADN double brin, anticorps cytoplasmique anti-neutrophile, facteur rhumatoïde et peroxydase anti-thyroïde) a été négative.
D’autres tests de laboratoire étaient dans les limites normales. Ceux-ci comprenaient: numération formule sanguine complète, tests de la fonction hépatique, tests de la fonction rénale, profil thyroïdien, cortisol sérique, antigène de surface de l’hépatite B, anticorps anti-hépatite C et tests d’anticorps anti-VIH. La tomodensitométrie (TDM) de l’abdomen du patient était normale sans anomalie du pancréas. Un scan DOTANOC au gallium 68 du corps entier n’a révélé aucune lésion suspecte.
Le patient a été initié à des repas fréquents à faible teneur en glucides. Par la suite, il a eu une résolution spontanée de l’hypoglycémie après 6 mois de présentation initiale. Au bout de 6 mois, ses titres d’autoanticorps en insuline étaient de 1,2 U /mL.
Cas 2
Un Indien de 50 ans s’est présenté à notre clinique avec une hypoglycémie récurrente depuis un mois. Ces épisodes ont été caractérisés par des symptômes neuroglycopéniques avec des valeurs de glucose documentées au glucomètre variant de 35 à 60 mg / dL. Ces symptômes ont été corrigés par la prise d’un régime à base de glucides, remplissant ainsi la triade de Whipple. Ces épisodes se sont produits 5 à 6 heures après les repas. Il n’y avait pas d’antécédents d’exposition à l’insuline, à un hypoglycémiant oral ou à un médicament connu pour précipiter l’hypoglycémie. Le patient n’était pas diabétique.
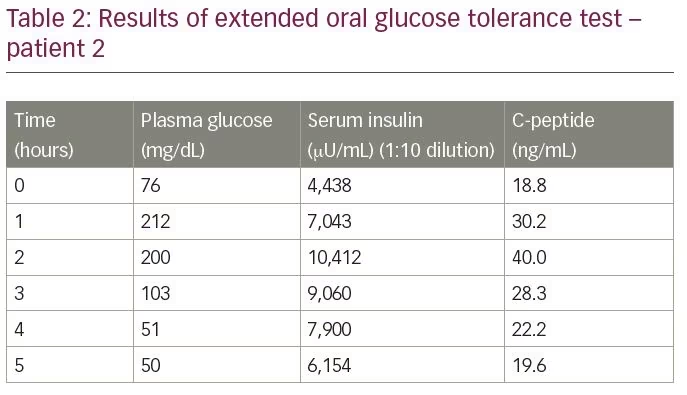
Le patient a été admis pour une évaluation de l’hypoglycémie. Un test de tolérance orale prolongée au glucose a révélé une glycémie de fin d’essai de 50 mg / dL, avec un taux d’insuline correspondant de 6 154 µU / mL et un peptide C de 19,6 ng / mL, mesurée par dosage par électrochimiluminescence (tableau 2). Le rapport molaire Insuline/peptide C était de 1,1 (plus de 1). Les résultats du scan DOTANOC au gallium 68 et du scan exendin étaient dans les limites normales. Pour confirmer le diagnostic, des titres d’autoanticorps d’insuline ont été mesurés, qui étaient de 68,8 U / mL.
Ce patient a également commencé à prendre des repas fréquents, petits et faibles en glucides. Il n’a pas eu de récidive d’hypoglycémie jusqu’à présent (1 an après le diagnostic) et fait l’objet de soins de suivi.
Discussion
L’IAS – ou maladie de Hirata – est un cas rare d’hypoglycémie hyperinsulinémique. Cette condition a été décrite pour la première fois par Hirata et al. en 1970.11, il existe une forte association avec HLA-DR4.12 Malheureusement, en raison de contraintes de ressources, le génotypage HLA n’a pas pu être effectué chez nos patients.
Les patients atteints d’IAS sont généralement présents à l’âge adulte, et il n’y a aucune prédilection pour aucun sexe. Les épisodes hypoglycémiques surviennent généralement à l’état post-absorption, bien que des cas d’hypoglycémie induite par le jeûne et l’exercice aient également été rapportés.13 L’IAS est généralement associée à d’autres affections auto-immunes, telles que la maladie de Graves, le lupus érythémateux disséminé, la polyarthrite rhumatoïde et la spondylarthrite ankylosante. Aucun de nos patients n’avait d’antécédents de maladie auto-immune associée.
La plupart des patients sont également exposés à des médicaments avant la précipitation de l’hypoglycémie. Les médicaments couramment impliqués sont le méthimazole, le carbimazole, le glutathion, la tiopronine, l’interféron α, le captopril, le diltiazem, l’hydralazine, le procaïnamide, l’isoniazide, la D-pénicillamine, l’imipénème et la pénicilline G. L’acide alpha-lipoïque 14 – un supplément de santé populaire – a également été lié aux IAS.15 Dans un autre rapport de cas de notre institut, il a été constaté que les inhibiteurs de la pompe à protons induisaient une hypoglycémie.2
Le mécanisme de l’hypoglycémie dans l’IAS est supposé être causé par la présence de grandes quantités d’auto-anticorps anti-insuline (IAA). Après la nourriture, il y a une augmentation de la glycémie, suivie d’une augmentation des taux d’insuline. L’insuline est alors liée par l’AAI, ce qui rend l’insuline inefficace, ce qui conduit ensuite à une hyperglycémie postprandiale. Cela déclenche la production de quantités accrues d’insuline et de peptide C pour faire face à l’hyperglycémie postprandiale. Les complexes Insuline-IAA créent une réserve d’insuline: lorsque la dissociation se produit, il y a une libération prolongée d’insuline libre dans l’état
post-absorption, entraînant une hypoglycémie plus prolongée et plus sévère. Les médicaments du groupe sulfhydryle agissent comme des haptènes; ils interagissent avec les liaisons disulfures de l’insuline et augmentent son immunogénicité.
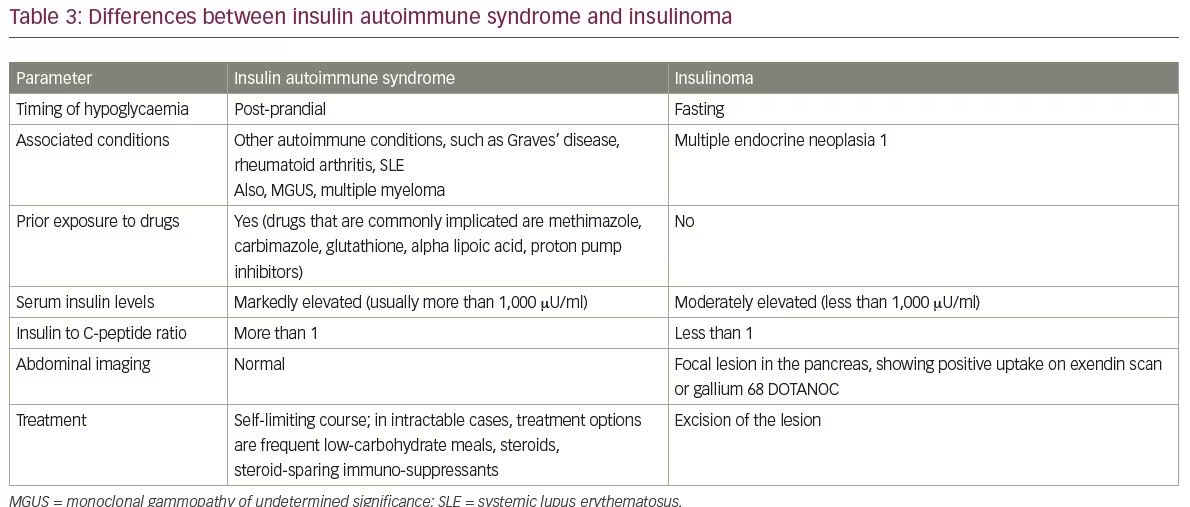
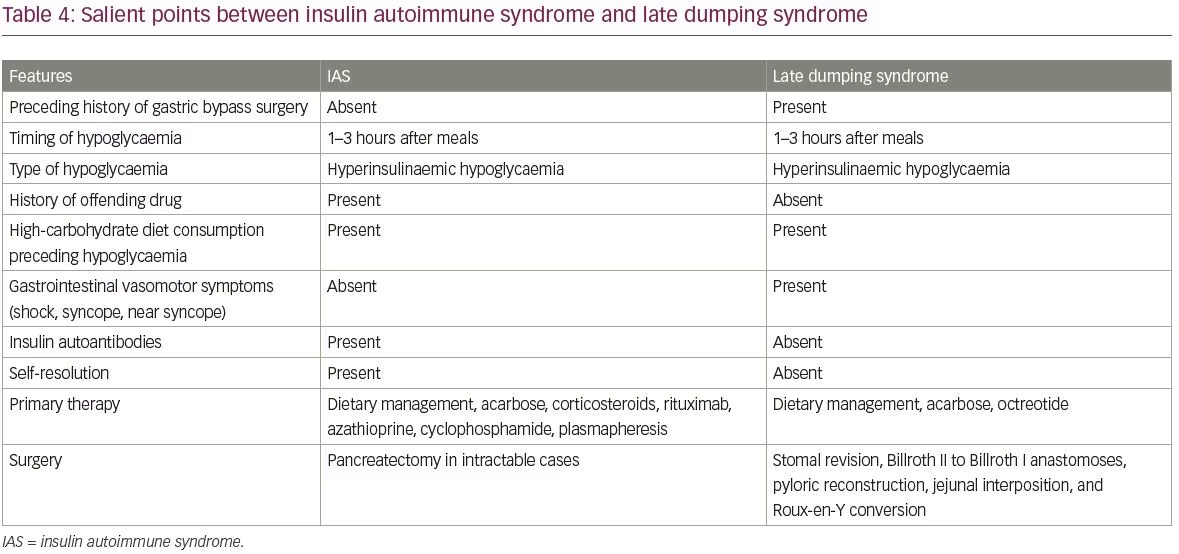
Les diagnostics différentiels courants d’IAS comprennent l’insulinome et la prise exogène d’insuline et de sulfonylurées. Les différences entre les insulinomes et les IAS sont résumées dans le tableau 3. Un autre diagnostic différentiel d’IAS est l’hypoglycémie causée par le syndrome de dumping tardif. Les points saillants entre IAS et syndrome de dumping tardif sont couverts dans le tableau 4.
La mesure des titres d’autoanticorps d’insuline est obligatoire pour le diagnostic d’IAS.16 Cependant, une lacune fréquente dans la plupart des dosages disponibles dans le commerce est que seule la classe des auto-anticorps de l’insuline immunoglobuline-G peut être détectée.1 Par conséquent, les résultats peuvent être faussement négatifs si les auto-anticorps sont d’une classe différente.1 Dans ce cas, la précipitation du sérum avec du polyéthylène glycol (PEG), suivie d’une récupération de l’insuline dans le surnageant, peut servir de mesure indirecte pour détecter les auto-anticorps de l’insuline.17 En cas de suspicion d’IAS, il existe une différence marquée entre les taux sériques d’insuline totale et d’insuline libre après précipitation du PEG.3 Dans l’IAS, après la précipitation du PEG, les niveaux d’insuline liée sont généralement beaucoup plus élevés, tandis que ceux d’insuline libre sont plus bas; l’inverse est observé chez les témoins sains.3
Le rapport molaire de l’insuline sur le peptide C peut être utilisé comme marqueur pour le diagnostic d’IAS. L’insuline et le peptide C sont sécrétés par les cellules bêta à des concentrations équimolaires, mais l’insuline est éliminée rapidement, avec une demi-vie de 5 minutes, tandis que le peptide C a une demi-vie de 30 minutes. Par conséquent, chez les individus normaux et les insulinomes, le rapport molaire insuline/ peptide C est inférieur à 1,18 Ce rapport est supérieur à 1 dans deux conditions; à savoir, l’IAS et l’administration d’insuline exogène, où le peptide C est supprimé.18 Chez nos deux patients, le rapport molaire insuline/peptide C était supérieur à 1.
Il n’y a généralement pas d’anomalies pathologiques du pancréas dans l’IAS, mais une hyperplasie des îlots pancréatiques a été rapportée chez un patient.19 Dans un autre cas d’IAS, une nesidioblastose a été rapportée lors d’une biopsie pancréatique.20
La plupart des cas d’IAS sont auto-limitatifs, la résolution des symptômes ayant lieu dans les 3 à 6 mois suivant le diagnostic initial.1 Le mécanisme exact de l’auto-résolution n’est pas connu, mais des preuves circonstancielles suggèrent que lorsque l’antigène (par exemple le médicament sulfhydrylique) est retiré, les anticorps peuvent s’user sur une période de temps.1 Cappellani et coll. ont démontré que dans les IAS induits par l’acide alpha-lipoïque, les niveaux d’auto-anticorps de l’insuline ont chuté après le retrait de l’agent incitatif (c’est-à-dire l’acide alpha-lipoïque).21
Chez les patients présentant une hypoglycémie intraitable, le traitement de première intention comprend de petits repas fréquents et faibles en glucides, afin d’éviter une hyperglycémie postprandiale et une augmentation subséquente
de l’insuline. Des cours courts de corticostéroïdes (prednisolone orale 30-60 mg) peuvent être utilisés comme traitement d’appoint.22,23 Les autres agents de traitement comprennent l’acarbose (pour réduire l’absorption des glucides), le diazoxide, l’octréotide et la pancréatectomie partielle (pour limiter la libération d’insuline) et la plasmaphérèse (pour réduire les titres d’autoanticorps d’insuline).20,22,24,25 Immunosuppresseurs, tels que l’azathioprine, le cyclophosphamide et le mycophénolate mofétil ont également été essayés en IAS.Le rituximab 4,26,27, un anticorps monoclonal anti-CD20, a également été utilisé avec succès dans quelques cas insolubles où il y avait un échec de réponse aux stéroïdes.28-31
Conclusion
Nous avons décrit deux cas d’IAS, une cause rare d’hypoglycémie hyperinsulinémique endogène. L’IAS doit être suspectée chez tout patient présentant habituellement une hypoglycémie postprandiale, avec une concentration d’insuline anormalement élevée et des taux de pro-insuline et de peptide C modérément élevés. Le rapport molaire insuline/ peptide C est supérieur à 1 dans IAS. Le diagnostic peut être confirmé par la mesure des titres d’auto-anticorps de l’insuline. Un diagnostic approprié peut éviter des investigations injustifiées et une exploration abdominale. La plupart des cas sont auto-limitatifs, tandis que quelques cas insolubles peuvent nécessiter des modifications alimentaires, des corticostéroïdes ou des immunosuppresseurs épargneurs de stéroïdes.