az inzulin autoimmun szindróma (IAS) a hipoglikémia egyik vezető oka a japán populációban.1 Indiában, amelynek lakossága meghaladja az 1 milliárdot, a legjobb tudomásunk szerint eddig csak 28 IAS-esetet jelentettek.A 2-10 IAS-t hyperinsulinaemiás hypoglykaemia-emelkedett autoantitest inzulin titer jellemzi, előzetes exogén inzulin expozíció nélkül. Az IAS legtöbb esete önkorlátozó. Itt beszámolunk a ritka betegség két esetével kapcsolatos tapasztalatainkról.
1.eset
egy 48 éves indiai férfi jelentkezett endokrin klinikánkon, ismételt súlyos hipoglikémiás epizódokkal az elmúlt 4 hónapban. Ezek az epizódok étkezés után 3-4 órával jelentkeztek, és fokozott éhség, szédülés, palpitáció, remegés és verejtékezés tünetei jellemezték őket. A tüneteket megfordította a beteg szénhidrát alapú étkezés közben. A beteg glükométert kapott, és a tüneti epizódok során a vércukorszintje 30 és 40 mg/dL között változott. Az anamnézisben nem szerepelt éhomi hypoglykaemia.
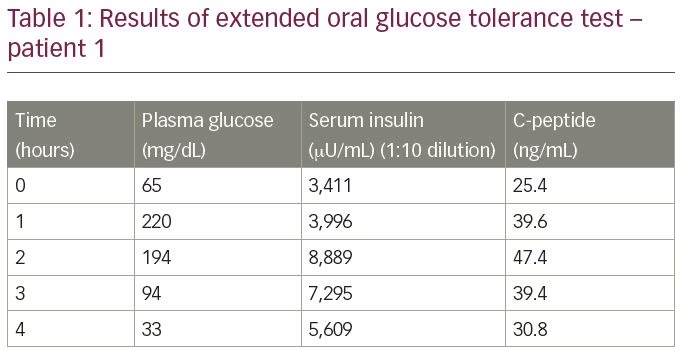
a beteg nem volt diabeteses, és nem volt a kórtörténetében inzulin, inzulinszekréciót fokozó szerek vagy más olyan gyógyszer expozíciója, amelyről ismert, hogy hypoglykaemiát vált ki. Kiterjesztett orális glükóz tolerancia tesztnek vetették alá, amelynek eredményeit az 1.táblázat foglalja össze. A vizsgálati eredmény 33 mg/dL plazma glükózszintet mutatott ki, a megfelelő szérum inzulin 5609 db/ml (normál tartomány
-9,2–138,9 db/ml) és a szérum C-peptid 30,9 ng/mL (normál tartomány 1,1–4) volt.4 ng/mL), elektrokemilumineszcencia vizsgálattal mérve (Roche Diagnostics, Rotkreuz, Svájc). Az inzulin mólaránya a C-peptidhez 3:8 volt (több mint 1). A laboratóriumi értékek felvetették az IAS gyanúját. A diagnózis megerősítésére az inzulin antitest titereket enzim immunoassay-vel mértük; a szint több mint 300 U/mL volt (normál tartomány <12 U/mL). Más autoantitestek (antinukleáris antitest, anti-kettős szálú DNS antitest, anti-neutrofil citoplazmatikus antitest, rheumatoid faktor és anti-pajzsmirigy peroxidáz) analízise negatív volt.
más laboratóriumi vizsgálatok a normál határokon belül voltak. Ezek a következők voltak: teljes vérkép, májfunkciós tesztek, vesefunkciós tesztek, pajzsmirigy profil, szérum kortizol, hepatitis B felszíni antigén, hepatitis C elleni antitest és HIV antitest tesztek. A beteg hasának számítógépes tomográfiája (CT) normális volt, a hasnyálmirigy rendellenessége nélkül. Az egész test gallium 68 DOTANOC vizsgálata nem tárt fel gyanús elváltozásokat.
a beteget gyakran kezdték alacsony szénhidráttartalmú étkezés. Ezt követően a hypoglykaemia spontán rendeződött 6 hónapos kezdeti megjelenés után. A 6 hónap végén az inzulin autoantitest titere 1,2 E/mL volt.
2.eset
egy 50 éves indiai férfi visszatérő hipoglikémiával jelentkezett klinikánkon az elmúlt hónapban. Ezeket az epizódokat neuroglycopeniás tünetek jellemezték, a glükométeren dokumentált glükózértékek 35 és 60 mg/dL között változtak. Ezeket a tüneteket szénhidrát alapú étrend bevitelével korrigálták, így teljesítve Whipple triádját. Ezek az epizódok az étkezés után 5-6 órával jelentkeztek. A kórtörténetben nem szerepelt inzulin, orális antidiabetikum vagy bármely olyan gyógyszer, amely ismerten kiváltotta a hypoglykaemiát. A beteg nem cukorbeteg volt.
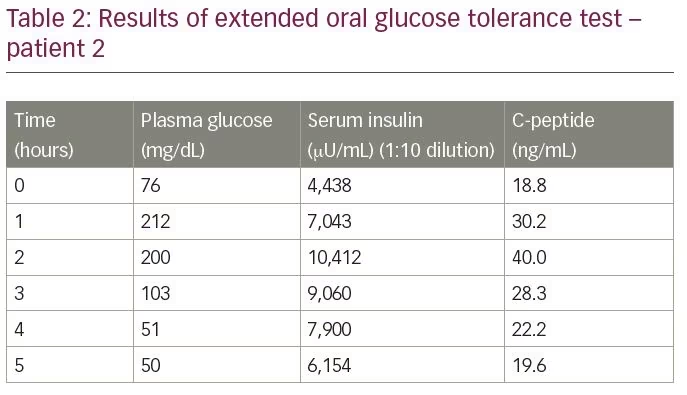
a beteget felvették a hypoglykaemia értékelésére. Egy kiterjesztett orális glükóztolerancia-teszt 50 mg/dL-es vércukor-értéket mutatott, ennek megfelelő inzulinszint 6154 MNG/mL volt, a C-peptid pedig 19,6 ng/mL, elektrokemilumineszcencia vizsgálattal mérve (2.táblázat). Az inzulin / C-peptid mólarány 1,1 volt (több mint 1). Mind a gallium 68 DOTANOC vizsgálat, mind az exendin vizsgálat eredményei a normál határokon belül voltak. A diagnózis megerősítésére az inzulin autoantitest titerét mértük, amely 68,8 U/mL volt.
ezt a beteget gyakori, kicsi, alacsony szénhidráttartalmú ételekkel is elkezdték. Ezidáig (a diagnózis felállítása után 1 évvel) nem jelentkezett a hipoglikémia kiújulása, és utókezelés alatt áll.
megbeszélés
az IAS – vagy Hirata – kór-a hyperinsulinaemiás hypoglykaemia ritka esete. Ezt az állapotot először Hirata et al. 1970.11-ben erős kapcsolat van a HLA-DR4 – gyel.12 sajnos az erőforrás-korlátok miatt a HLA genotipizálást nem lehetett elvégezni betegeinknél.
az IAS-ben szenvedő betegek általában felnőttkorban vannak jelen, és semmilyen nemre nincs predilekció. Hypoglykaemiás epizódok általában abszorpció utáni állapotban fordulnak elő, bár beszámoltak éhgyomri és testmozgás által kiváltott hypoglykaemiáról is.13 Az IAS gyakran társul más autoimmun állapotokkal, mint például a Graves-kór, a szisztémás lupus erythematosus, a rheumatoid arthritis és a spondylitis ankylopoetica. Egyik betegünknek sem volt kórtörténetében más autoimmun betegség.
a legtöbb beteg a hipoglikémia kicsapódása előtt is gyógyszereknek van kitéve. A leggyakoribb gyógyszerek, amelyek érintettek, a metimazol, karbimazol, glutation, tiopronin, interferon-ons, kaptopril, diltiazem, hidralazin, prokainamid, izoniazid, D-penicillamin, imipenem és penicillin G. 14 alfa-liponsav – egy népszerű egészségügyi kiegészítés – szintén kapcsolódik az IAS-hez.15 Intézetünk egy másik esetjelentésében a protonpumpa-gátlók hipoglikémiát indukáltak.2
az IAS-ben a hypoglykaemia mechanizmusát feltételezik, hogy nagy mennyiségű inzulin autoantitest (IAA) jelenléte okozza. Étkezés után emelkedik a vércukorszint, amelyet az inzulinszint emelkedése követ. Az inzulint ezután az IAA köti, így az inzulin hatástalan, ami étkezés utáni hiperglikémiához vezet. Ez fokozott mennyiségű inzulin és C-peptid termelődését váltja ki az étkezés utáni hiperglikémia kezelésére. Az inzulin-IAA komplexek inzulin tartalékot hoznak létre: disszociáció esetén a szabad inzulin
abszorpció utáni állapotban tartósan felszabadul, ami hosszabb ideig tartó és súlyos hypoglykaemiához vezet. A szulfhidrilcsoport-gyógyszerek hapténként hatnak; kölcsönhatásba lépnek az inzulin diszulfidkötéseivel és növelik annak immunogenitását.
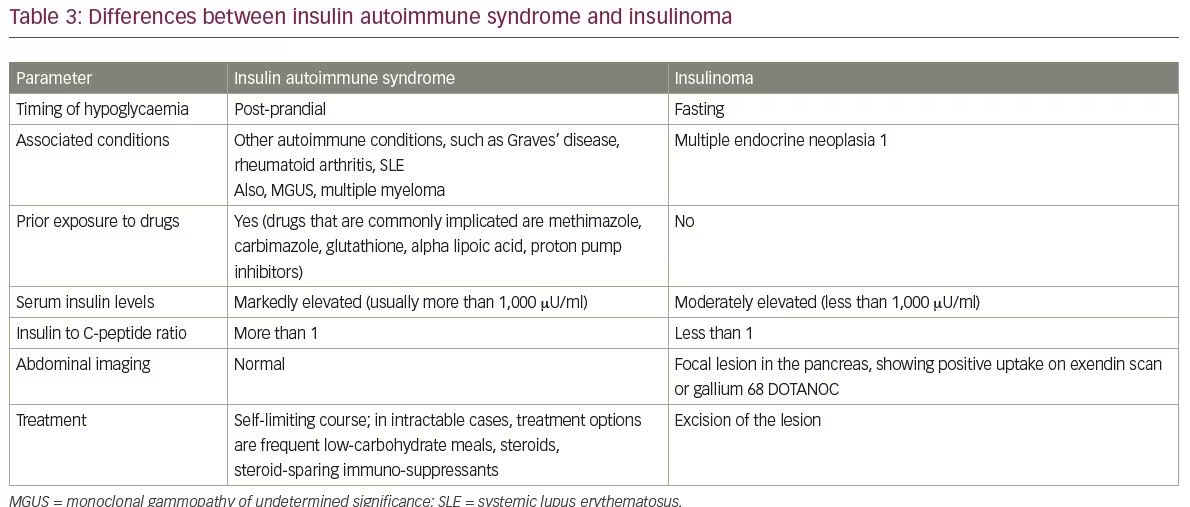
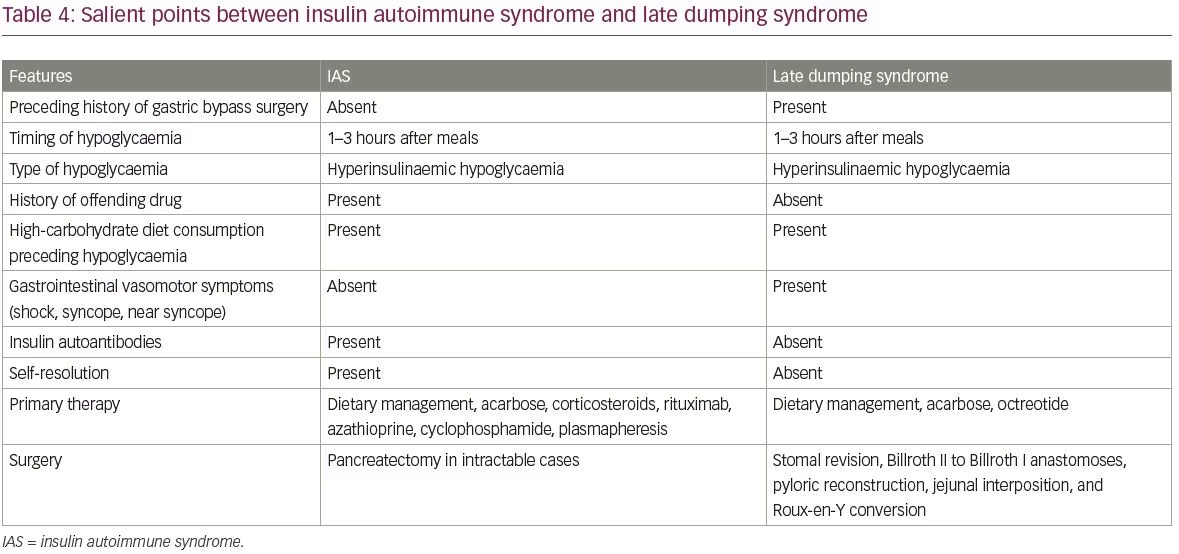
az IAS gyakori differenciáldiagnózisai közé tartozik az inzulinóma és az inzulin és a szulfonilureák exogén bevitele. Az inzulinómák és az IAS közötti különbségeket a 3. táblázat foglalja össze. Az IAS másik differenciáldiagnózisa a késői dömping szindróma által okozott hipoglikémia. Az IAS és a késői dömping szindróma közötti legfontosabb pontokat a 4. táblázat tartalmazza.
az inzulin autoantitest titerek mérése kötelező az IAS diagnosztizálásához.16 a kereskedelemben kapható vizsgálatok többségében azonban gyakori hiányosság, hogy csak az inzulin autoantitestek immunglobulin-G osztályát lehet kimutatni.1 ennélfogva az eredmények hamisan negatívak lehetnek, ha az autoantitestek más osztályba tartoznak.1 ebben az esetben a szérum polietilénglikollal (PEG) történő kicsapódása, majd az inzulin felülúszóban történő visszanyerése közvetett intézkedésként szolgálhat az inzulin autoantitestek kimutatására.17 IAS gyanúja esetén jelentős különbség van a teljes szérum és a szabad inzulin szintjében a PEG kicsapódás után.3 az IAS-ben a PEG kicsapódás után a kötött inzulin szintje általában sokkal magasabb, míg a szabad inzuliné alacsonyabb; ennek fordítottja látható az egészséges kontrollokban.3
az inzulin és a C-peptid mólaránya használható markerként az IAS diagnózisához. Az inzulin és a C-peptid ekvimoláris koncentrációban választódik ki a béta-sejtekből, de az inzulin gyorsan ürül, felezési ideje 5 perc, míg a C-peptid felezési ideje 30 perc. Ezért normál egyénekben és inzulinómákban az inzulin / C-peptid mólarány kisebb, mint 1,18 ez az arány nagyobb, mint 1 két körülmények között; nevezetesen az IAS és az exogén inzulin beadása, ahol a C-peptid elnyomódik.18 mindkét betegünknél az inzulin – C-peptid mólarány nagyobb volt, mint 1.
az IAS-ben általában nincsenek a hasnyálmirigy kóros rendellenességei, de egy betegnél hasnyálmirigy-szigetek hiperpláziájáról számoltak be.19 az IAS egy másik esetben a hasnyálmirigy biopsziáján nesidioblastosisról számoltak be.20
az IAS legtöbb esete önkorlátozó, a tünetek a kezdeti diagnózistól számított 3-6 hónapon belül megszűnnek.1 az önfelbontás pontos mechanizmusa nem ismert, de a közvetett bizonyítékok arra utalnak, hogy az antigén (például a szulfhidrilkészítmény) kivonásakor az antitestek egy bizonyos idő alatt elhasználódhatnak.1 Cappellani et al. kimutatták, hogy az alfa-liponsav által indukált IAS-ben az inzulin autoantitest szintje leesett az ingerlő szer (azaz az alfa-liponsav) kivonása után.21
kezelhetetlen hypoglykaemiában szenvedő betegek esetében az elsővonalbeli kezelés kis mennyiségű, gyakori, alacsony szénhidráttartalmú étkezést foglal magában, hogy elkerüljék az étkezés utáni hyperglykaemiát és az inzulinszint ezt követő
emelkedését. Rövid kortikoszteroidok (orális prednizolon 30-60 mg) adjuváns terápiaként alkalmazhatók.22,23 a kezelés egyéb ágensei közé tartozik az akarbóz (a szénhidrát felszívódásának csökkentésére), a diazoxid, az oktreotid és a részleges pancreatectomia (az inzulin felszabadulásának korlátozására) és a plazmaferezis (az inzulin autoantitest titerének csökkentésére).20,22,24,25 immunszuppresszánsokat, például azatioprint, ciklofoszfamidot és mikofenolát-mofetilt is kipróbáltak az IAS-ben.4,26,27 a rituximabot, egy anti-CD20 monoklonális antitestet is sikeresen alkalmazták néhány kezelhetetlen esetben, amikor a szteroidokra adott válasz sikertelen volt.28-31
következtetés
két IAS-esetet írtunk le, amely az endogén hyperinsulinaemiás hypoglykaemia ritka oka. Az IAS gyanúja minden olyan betegnél fennáll, akinél rendszerint étkezés utáni hypoglykaemia, szokatlanul magas inzulinkoncentráció, valamint mérsékelten emelkedett pro-inzulin és C-peptid szint áll fenn. Az inzulin-C-peptid mólarány több mint 1 az IAS-ben. A diagnózist az inzulin autoantitest titerének mérésével lehet megerősíteni. A megfelelő diagnózis elkerülheti az indokolatlan vizsgálatokat és a hasi feltárást. A legtöbb eset önkorlátozó, míg néhány kezelhetetlen eset étrendi módosításokat, kortikoszteroidokat vagy szteroidmegtakarító immunszuppresszánsokat igényelhet.