インスリン自己免疫症候群(IAS)は、日本人の低血糖の主要な原因である。1 10億人以上の人口を持つインドでは、私たちの知る限り、これまでに報告されているIASの症例はわずか28例です。2-10IASは外因性のインシュリンへの前の露出無しでhyperinsulinaemic hypoglycaemia高められたインシュリンの自己抗体の力価によって特徴付けられます。 IASのほとんどの症例は自己制限的である。 ここでは、このまれな疾患の二つのケースで私たちの経験を報告します。
ケース1
48歳のインド人男性が、過去4ヶ月間重度の低血糖症のエピソードを繰り返し内分泌クリニックに提示しました。 これらのエピソードは、食事の3-4時間後に発生し、飢餓、めまい、動悸、振戦および発汗の増加の症状によって特徴付けられた。 症状は、患者が炭水化物ベースの食事を食べることによって逆転した。 患者はglucometerを得、徴候のエピソードの間に彼の血ブドウ糖の読書は30そして40mg/dLの間で変わりました。 空腹時低血糖症の既往はなかった。
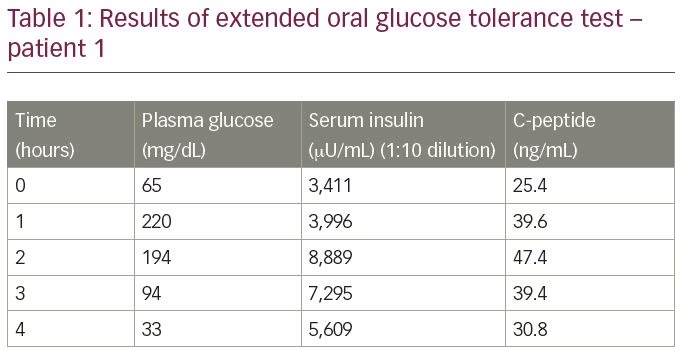
患者は非糖尿病であり、インスリン、インスリン分泌促進薬、または低血糖を沈殿させることが知られている薬物への曝露の病歴はなかった。 彼は、拡張経口耐糖能試験に供され、その結果は表1に要約される。 試験結果は、5,609μ u/mLの対応する血清インスリンと33mg/dLの血漿グルコースを明らかにした(正常範囲
-9.2–138.9μ u/mL)と30.9ng/mLの血清C-ペプチド(正常範囲1.1–4。(Roche Diagnostics,Rotkreuz,Switzerland)によって測定される。 Cペプチドに対するインスリンのモル比は3:8(1以上)であった。 研究室の値は、IASの疑いを提起しました。 診断を確認するために、インスリン抗体価を酵素イムノアッセイによって測定し、レベルは300U/mL以上(正常範囲<12U/mL)であった。 他の自己抗体(抗核抗体,抗二本鎖DNA抗体,抗好中球細胞質抗体,リウマチ因子,抗甲状腺ペルオキシダーゼ)の解析は陰性であった。
他の実験室試験は正常な限界の内にありました。 これらには、完全な血球数、肝機能検査、腎機能検査、甲状腺プロファイル、血清コルチゾール、B型肝炎表面抗原、抗c型肝炎抗体およびHIV抗体検査が含まれ 腹部c tは正常で,すいに異常はなかった。 全身のガリウム68ドタノックスキャンは疑わしい病変を明らかにしなかった。
患者は頻繁な低炭水化物食事で開始された。 その後、彼は最初のプレゼンテーションの6ヶ月後に低血糖の自発的な解像度を持っていました。 6ヶ月の終わりに、彼のインスリン自己抗体価は1.2U/mLであった。
ケース2
50歳のインド人男性が、過去一ヶ月の再発性低血糖症で当院に提示しました。 これらのエピソードは35から60mg/dLまで変わるglucometerの文書化されたブドウ糖の価値が付いているneuroglycopenic徴候によって特徴付けられました。 これらの症状は、炭水化物ベースの食事の摂取によって修正され、ホイップルのトライアドを達成した。 これらのエピソードは、食事の5-6時間後に発生しました。 インスリン、経口低血糖薬または低血糖を沈殿させることが知られている任意の薬物への曝露の病歴はなかった。 患者は非糖尿病であった。
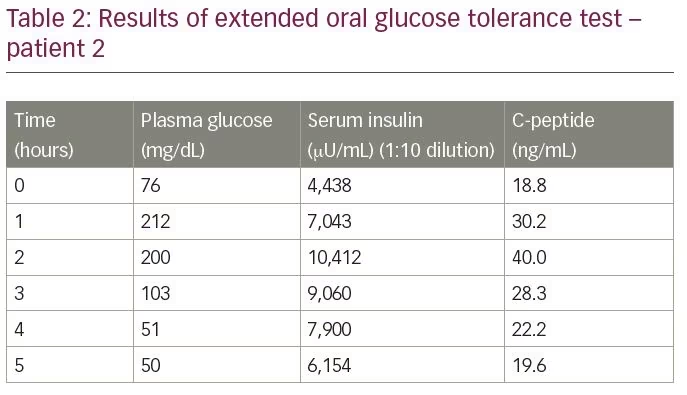
患者は低血糖の評価のために入院した。 拡張経口耐糖能試験は、電気化学発光アッセイ(表2)によって測定された6,154μ u/mLの対応するインスリンレベルと19.6ng/mLのC-ペプチドと、50mg/dLのテス インスリン対C-ペプチドモル比は1.1(1以上)であった。 ガリウム68DOTANOCスキャンとexendinスキャンの両方の結果は正常範囲内であった。 診断を確認するために、インスリン自己抗体価を測定し、これは68.8U/mLであった。
この患者はまた、頻繁に、小さな、低炭水化物の食事に開始されました。 彼はこれまでのところ低血糖の再発(診断後1年)を持っておらず、フォローアップケア中です。
ディスカッション
Ias–または平田病–は、高インスリン血性低血糖症のまれな症例である。 この状態は、平田らによって最初に記述された。 1970年11月にはHLA-DR4との強い関連がある。12残念ながら、資源の制約のために、HLAジェノタイピングは、我々の患者で行うことができませんでした。
IASの患者は通常成人期に存在し、性別に対する好みはありません。 Hypoglycaemicエピソードはまた絶食および練習誘発のhypoglycaemiaの報告があったが、ポスト吸収の状態に通常起こります。13IASは、一般に、バセドウ病、全身性エリテマトーデス、関節リウマチおよび強直性脊椎炎などの他の自己免疫状態と関連している。 私たちの患者のどちらも、他の関連する自己免疫状態の病歴を持っていませんでした。
ほとんどの患者はまた、低血糖の沈殿前に薬物に曝露されている。 関連する一般的な薬物は、メチマゾール、カルビマゾール、グルタチオン、チオプロニン、インターフェロン-α、カプトプリル、ジルチアゼム、ヒドララジン、プロカインアミド、イソニアジド、D-ペニシラミン、イミペネムであり、ペニシリンG.14Α-リポ酸–人気のある健康補助食品–もIASにリンクされている。15私たちの研究所からの別の症例報告では、プロトンポンプ阻害剤は低血糖を誘導することが判明した。2
IASにおける低血糖のメカニズムは、インスリン自己抗体(IAA)が大量に存在することによって引き起こされると仮定される。 食物の後、血糖値が上昇し、続いてインスリンレベルが上昇する。 インスリンはIAAによって結合され、インスリンを無効にし、食後高血糖を引き起こす。 これは食後のhyperglycaemiaに対処するためにインシュリンおよびcペプチッドの増加された量の生産を誘発します。 インスリン-IAA複合体は、インスリンの予備を作成します: 解離が起こると、
吸収後の状態で遊離インスリンが持続的に放出され、より長期かつ重度の低血糖症につながる。 スルフヒドリル基薬はハプテンとして作用し、インスリンのジスルフィド結合と相互作用し、その免疫原性を増強する。
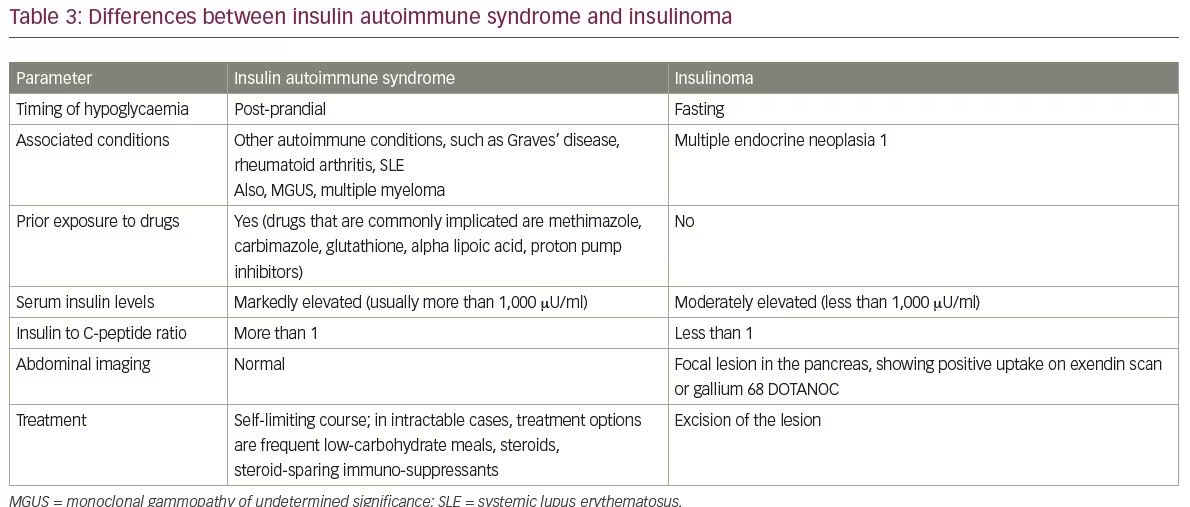
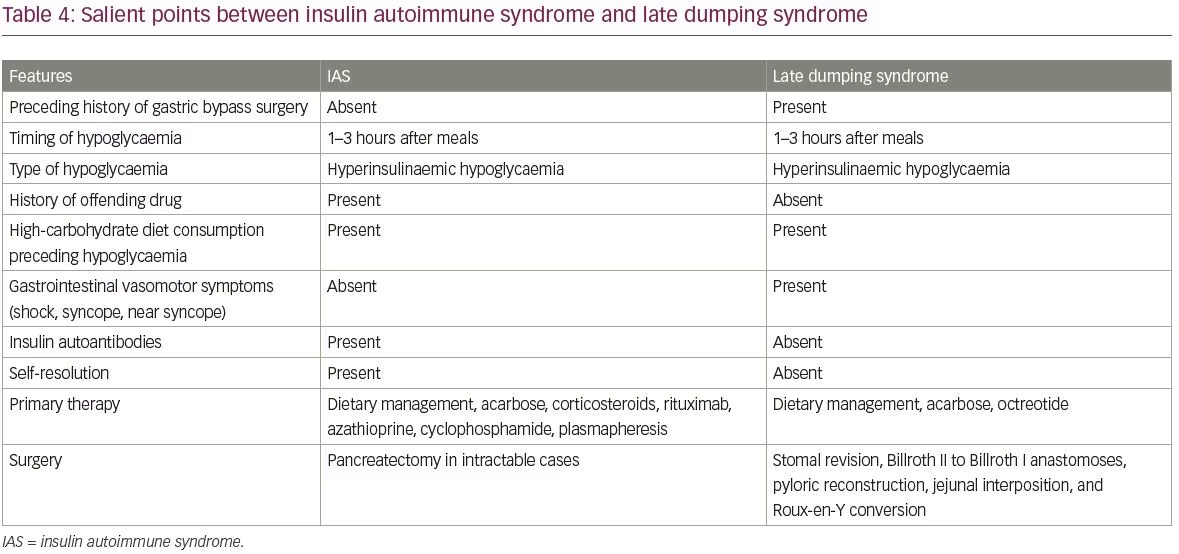
IASの一般的な鑑別診断には、インシュリノーマおよびインスリンおよびスルホニル尿素の外因性摂取が含まれる。 InsulinomasとIAS間の相違は表3に要約されます。 IASの別の鑑別診断は、後期ダンピング症候群によって引き起こされる低血糖である。 IASと後期ダンピング症候群の間の顕著な点は、表4にカバーされています。
インスリン自己抗体価の測定は、IASの診断に必須である。しかし、市販のアッセイの大部分において共通の欠点は、インスリン自己抗体の免疫グロブリン−Gクラスのみが検出され得ることである。したがって、自己抗体が異なるクラスのものである場合、結果は誤って陰性である可能性がある。1その場合、ポリエチレングリコール(PEG)による血清の沈殿、続いて上清中のインスリンの回収は、インスリン自己抗体を検出するための間接的な尺度とし17IASの疑いがある場合、PEG沈殿後の血清総および遊離インスリンのレベルに著しい差がある。3IASでは、止め釘の沈殿物の後で、結合されたインシュリンのレベルは通常自由なインシュリンのそれらはより低いが、大いにより高いです;逆は健康な対照で見られます。3
cペプチドに対するインスリンのモル比は、IASの診断のためのマーカーとして使用することができる。 インシュリンおよびcペプチッドは等モル集中のベータ細胞から分泌しますが、cペプチッドに30分の半減期がある一方インシュリンは、5分の半減期と、急速に取り除かれます。 従って、正常な個人およびinsulinomasで、cペプチッドモルの比率へのインシュリンは1.18よりより少しですこの比率は2つの条件の1より大きいです;即ち、18両方の患者では、c-ペプチドモル比に対するインスリンは1よりも大きかった。
通常、iasには膵臓の病理学的異常はないが、ある患者では膵島の過形成が報告されている。19IASの別のケースでは、nesidioblastosisは膵臓のバイオプシーで報告されました。20
IASのほとんどの症例は自己制限的であり、初期診断から3-6ヶ月以内に症状の解決が行われます。1自己分解の正確なメカニズムは知られていないが、状況証拠は、抗原(例えば、スルフヒドリル薬)が回収されると、抗体が一定期間にわたって摩耗する1カッペラーニ他 α-リポ酸によって誘導されるIAでは、誘発剤(すなわちα-リポ酸)が回収された後にインスリン自己抗体レベルが低下することが実証されている。21
難治性低血糖症の患者では、ファーストライン治療には、食後の高血糖およびその後のインスリンの上昇を避けるために、炭水化物が少ない少量の頻繁な食事が含まれる。
コルチコステロイド(口頭prednisolone30-60mg)の短いコースは付加的な療法として使用されるかもしれません。22,23治療の他の薬剤には、アカルボース(炭水化物の吸収を減少させるため)、ジアゾキシド、オクトレオチドおよび部分膵切除(インスリン放出を制限するため)および血漿交換(インスリン自己抗体価を減少させるため)が含まれる。アザチオプリン、シクロホスファミド、ミコフェノール酸モフェチルなどの20,22,24,25免疫抑制剤もIASで試みられている。4,26,27リツキシマブ、抗CD20モノクローナル抗体はまた、ステロイドへの応答の失敗があったいくつかの難治性のケースで正常に使用されています。28-31
結論
内因性高インスリン血症低血糖症のまれな原因であるIASの二つの症例について説明しました。 IASは通常食後のhypoglycaemiaと、異常に高いインシュリンの集中、および適度に上げられたプロインシュリンおよびCペプチッドのレベルと示すあらゆる患者で疑われるべきです。 Cペプチッドモルの比率へのインシュリンはIASの1より多くです。 診断は、インスリン自己抗体価の測定によって確認することができる。 適切な診断は不当な調査および腹部の調査を避けるかもしれません。 ほとんどの症例は自己制限的であるが、いくつかの難治性の症例は食餌療法の変更、コルチコステロイドまたはステロイド温存免疫抑制剤を必要とすることがある。