Abstrakt
primární leiomyosarkomy dolní duté žíly (IVC) jsou vzácné nádory se složitými anatomickými vztahy. Chirurgická resekce zůstává primárním přístupem k léčbě se selektivním použitím předoperačního záření a chemoterapie. Vzhledem k náchylnosti k lokální invazi těchto nádorů je často nutná radikální resekce okolních struktur. Zde popisujeme prezentaci, zpracování, operační řízení a výsledky těchto lézí v případě pacienta s nádorem zahrnujícím střední segment IVC. Vzhledem k rozsahu postižení, resekce IVC s en bloc pravou nefrektomií, pravá adrenalektomie, a částečná resekce levé renální žíly byla provedena s cévní rekonstrukcí pomocí protetického štěpu. S vhodným předoperačním plánováním a dobře koordinovaným multidisciplinárním přístupem lze bezpečně provést agresivní chirurgickou resekci a pacienti mohou těžit z příznivého dlouhodobého přežití.
přehled případů
pozadí
představující méně než 0,5% všech sarkomů měkkých tkání je leiomyosarkom (LMS) dolní duté žíly (IVC) méně častým novotvarem zahrnujícím hladký sval žíly.1 toto onemocnění je častěji pozorováno u žen (3: 1) v páté dekádě života.2 bylo zjištěno, že maximální průměr nádoru se pohybuje mezi 8-37 centimetry.3 Kromě postižení pravé ledviny nebo nadledvin bylo zaznamenáno přímé rozšíření do pravé nebo levé jater, infrarenální aorty, intrakardiální oblasti a supradiafragmatické pravé plíce.3 ve většině případů dostávají pacienti předoperační histologickou diagnózu buď perkutánní biopsií nebo laparotomií.3
zaměřená historie pacienta
73letá žena s anamnézou přerušované bolesti dolní části zad, otoku dolní končetiny a šestikilového úbytku hmotnosti v průběhu roku. Její předchozí anamnéza byla pozoruhodná pro hypertenzi, pro kterou užívala atenolol, hydrochlorothiazid, a nifedipin, stejně jako reflux, pro který byla udržována na omeprazolu. Po zpracování lékařem primární péče obdržela počítačovou tomografii (CT) skenování břicha a pánve prokazující hmotu podél juxtarenálního IVC, která byla biopsována a bylo zjištěno, že je v souladu s leiomyosarkomem (obr. 1).
fyzikální vyšetření
nejčastějším projevujícím se příznakem u pacientů s IVC LMS je bolest břicha (59,9%), následovaná edémem dolních končetin (14,8%), ztráta hmotnosti (11,4%), bolest zad (9,7%) a břišní distenze (9,3%).Předpokládá se, že edém 1-4 dolních končetin se vyskytuje pouze u zlomku pacientů pravděpodobně v důsledku vývoje žilních kolaterálů v prostředí pomalého růstu nádoru. Mnohem méně často je za prezentaci zodpovědná hluboká žilní trombóza (1, 7%) nebo Budd-Chiariho syndrom (1, 3%).1-4 další příznaky, jako je srdeční arytmie, mohou být přítomny u pacientů s prodloužením intrakardiálního nádoru do pravé síně. Jak již bylo zmíněno, náš pacient měl v anamnéze přerušovanou bolest dolní části zad, otok dolní končetiny a úbytek hmotnosti. Při fyzickém vyšetření se však dobře objevovala, měla měkké, něžné břicho bez hepatosplenomegalie a bylo zjištěno, že má needematózní distální končetiny. Její zkouška byla jinak nevšední.
zobrazování
axiální zobrazování pomocí CT nebo magnetické rezonance (MRI) představuje primární zobrazovací modalitu pro hodnocení pacientů s LMS, protože tyto skenování poskytují podrobnosti o rozsahu nádoru, lokální invaze a vzdálené nemoci. Na CT se LMS IVC jeví jako heterogenní, nekalcifikovaná hmota s periferním zesílením.5 MRI obrazy jsou pozoruhodné nízkou intenzitou signálu na T1 vážených obrazů a vysokou intenzitou signálu na T2 vážených obrazů.5 část pacientů může také dostat břišní ultrazvuk, kde Doppler v reálném čase může vymezit stupeň vaskulární obstrukce a trombózy. Ačkoli někteří autoři obhajovali invazivní studie,jako je vzestupná nebo retrográdní kavografie a selektivní arteriografie, 3 vzhledem ke zvýšenému rozlišení a rekonstrukcím, které lze získat neinvazivním axiálním zobrazením, se stávají méně běžnými. CT obrazy mohou být dále vylepšeny obrazy zpožděné fáze nebo žilní fáze, které mohou lépe vymezit IVC a zbytkový průtočný lumen. A konečně, u pacientů, u kterých existuje obava z intrakardiálního rozšíření nádoru, by měla být před operací získána transesofageální echokardiografie.
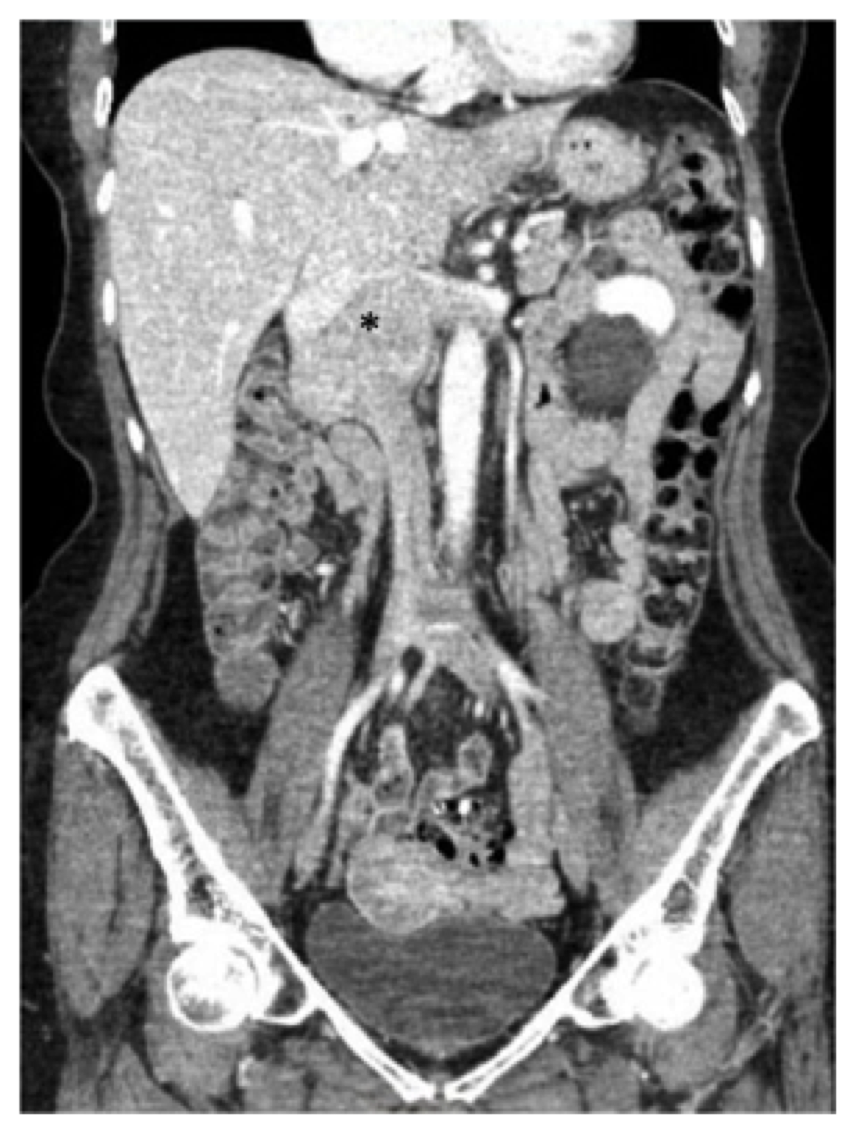 obr. 1, předoperační počítačová tomografie (CT) skenování břicha a pánve prokazující známý leiomyosarkom soustředěný v infrarenální dolní duté žíly (hvězdička), rozšiřující se nadřazeně na úroveň jaterního soutoku a bočně do renálních žil.
obr. 1, předoperační počítačová tomografie (CT) skenování břicha a pánve prokazující známý leiomyosarkom soustředěný v infrarenální dolní duté žíly (hvězdička), rozšiřující se nadřazeně na úroveň jaterního soutoku a bočně do renálních žil. pacient v této zprávě podstoupil CT vyšetření s kontrastem břicha a pánve a Zaznamenali jsme 7,5 cm hmotnost zahrnující IVC začínající na úrovni renálních žil (pravá renální žíla byla rozsáhle zapojena a došlo také k zapojení původu levé renální žíly) na úroveň – ale nezahrnující-jaterních žil (obr. 1). Bylo zjištěno, že dvanáctník a pankreas jsou posunuty dopředu bez důkazů o přímé invazi.
přírodní historie
bylo zjištěno, že primární IVC LMS je rovnoměrně fatální a bez 3letého přežití u pacientů, kteří dostali neúplnou resekci.1 při souhrnné analýze bylo u pacientů podstupujících chirurgickou resekci zjištěno nízké přežití bez onemocnění 1 a 5 let (DFS) (57%, respektive 6%). Celkové přežití však bylo příznivé (92% a 55%).2
možnosti léčby
kompletní chirurgická resekce je preferovanou léčbou pro pacienty, kteří mohou tolerovat chirurgický zákrok a často vyžadují en bloc resekci zúčastněných sousedních orgánů. Resekce s ligací IVC může být provedena pro infrarenální nádory nebo ty, které vyžadují resekci pravé ledviny, ve kterých se vytvořily podstatné kolaterály pro levou ledvinu. U přibližně čtvrtiny pacientů lze provést částečnou resekci IVC.3 bylo navrženo, že pokud je odstraněno 75% obvodu, je nutná kompletní resekce a rekonstrukce.6 pro ty, kteří vyžadují rekonstrukci, může být prstencová polytetrafluorethylenová (PTFE) protéza dimenzována tak,aby odpovídala a může být sešita na místě polypropylenovým stehem 4-0 nebo 5-0. Použití chemoterapie nebo radioterapie jako neoadjuvantní nebo adjuvantní terapie může mít rostoucí roli. Vzhledem k vzácnosti tohoto onemocnění a nedostatku dosud dostupných údajů o výsledcích léčby jsou však tyto způsoby v současné době přizpůsobeny každému jednotlivému pacientovi po multidisciplinární diskusi a existuje variabilita jejich aplikace.
zdůvodnění léčby
vzhledem k vzácnosti primárního IVC LMS existují omezené studie podporující neoperační přístup a kompletní chirurgická resekce zůstává optimální strategií řízení.2 ve snaze snížit riziko recidivy na retroperitoneálním okraji a také naočkování nádoru peritoneální dutiny v době chirurgické resekce zahrnuje naše institucionální praxe pro léčbu retroperitoneálního sarkomu neoadjuvantní radiační terapii následovanou radikální resekcí a chemoterapií, pokud to bude považováno za nutné po přezkoumání a projednání konečné explantační patologie. Konkrétně byl náš pacient zařazen do studie sponzorované Národním onkologickým institutem (NCI) (DFCI / HCC 12-100), ve které byli léčeni 63 Gray (Gy) na retroperitoneální okraj a 50.4 Gy do celé oblasti nádoru pomocí tužky paprsku skenování protony po dobu pěti týdnů. Pacient to dobře snášel, měl stabilní re-staging sken a následně pokračoval s radikální resekcí jejího retroperitoneálního sarkomu s en bloc resekcí pravé ledviny, pravé nadledviny, dolní duté žíly a části levé renální žíly, jak je podrobně popsáno níže (viz obrys postupu).
diskuse
první popis primárního IVC LMS byl v roce 1871 Perlem, 7 následovala první resekce Melchiorem v roce 1928, při které pacient zemřel 2 týdny po operaci.8 s pokroky umožňujícími předoperační plánování, zdokonalení chirurgické techniky a expozice a zlepšení v kritické péči je 30denní perioperační úmrtnost po resekci IVC LMS nyní 1,9%.2 zůstává však značná 30denní morbidita (24,7%).2 nicméně chirurgická resekce zůstává primární léčebnou strategií. S tímto přístupem bylo zjištěno, že dlouhodobé 5leté DFS jsou nízké (6%), zatímco 5leté celkové přežití bylo příznivé (55%).2
až donedávna byla řada zpráv v literatuře studující IVC LMS omezena malými velikostmi vzorků. Souhrnná analýza Wachtel et al. umožnila nejkomplexnější studii zahrnující 377 pacientů.2 po upravené analýze zahrnovaly faktory identifikované jako vedoucí ke snížení celkového přežití velkou velikost nádoru (≥9 cm), vyšší věk (≥55 let), potřebu resekce en bloc, stav pozitivního okraje, adjuvantní chemoterapie a umístění nádoru. Konkrétně jsou primární LEIOMYOSARKOMY IVC klasifikovány podle rozsahu žilního postižení a jsou popsány horní hranicí nádoru a stupněm rozšíření nádoru. Pomocí tohoto klasifikačního systému jsou nádory segmentu I infrarenální, segment II jsou interrenální a / nebo suprarenální až do suprahepatálních žil, ale bez suprahepatálních žil, a segment III jsou ty, které zasahují do suprahepatálních žil a mají možné intrakardiální rozšíření. Segment II, nebo střední segment, nádory jsou nejčastější a bylo zjištěno, že mají lepší výsledky než ty, které vznikají v segmentu I nebo segmentu III. 2,9 zčásti se předpokládá, že je to způsobeno včasným rozpoznáním nádorů v segmentu II v důsledku bližší anatomické blízkosti těchto nádorů k více orgánům, které mohou vést k bolesti nebo obstrukci.2 nádor našeho pacienta lze nejlépe klasifikovat jako lézi segmentu II.
několik komentářů týkajících se operativního postupu resekce a rekonstrukce IVC LMS vyžaduje další diskusi. Pokud jde o expozici, ve většině případů (60%) byl použit abdominální přístup (střední laparotomie nebo pravý subkostální řez), zatímco torakoabdominální přístup s možnou sternotomií lze použít v závislosti na odlišné anatomii resekovaného nádoru.3 konkrétně u nádorů zasahujících do retrohepatické nebo suprahepatické vena cava může být nezbytné úplné vyloučení jater pomocí upnutí IVC nad a pod játry kromě upnutí portální žíly. U pacientů s intrakardiální extenzí může být nutná odpovídající expozice umožňující kardiopulmonální bypass. Obecně platí, že pacienti s nádory izolovanými na infrahepatální a pararenální cava budou pravděpodobně tolerovat úplné křížové upnutí IVC bez významných hemodynamických změn, pokud je zajištěno dostatečné předpětí s vhodnou intraoperační resuscitací anesteziologickým týmem. Pokud jde o techniku, u pacientů s žilní hypertenzí (proximální žilní tlaky 30 mmHg nebo vyšší) se doporučuje rekonstrukce (na rozdíl od ligace, primární resekce nebo kavoplastiky), aby se zabránilo pooperačnímu edému dolních končetin.3 Kromě toho může být nutná reimplantace renálních nebo jaterních žil v závislosti na rozsahu resekce nádoru. V současné době neexistuje žádný standard pro pooperační antikoagulační léčbu a antiagregační aspirinová terapie, jak byla použita u našeho pacienta, který byl propuštěn na 325 mg aspirinu denně, je spojen s nízkou mírou pooperační trombózy štěpu.10
randomizované kontrolované studie hodnotící účinnost chemoterapie nebo radioterapie při léčbě IVC LMS nemusí být nikdy zveřejněny kvůli vzácnosti onemocnění. Konečná patologie našeho pacienta byla pozoruhodná pro leiomyosarkom stupně 2/3 (yPT2bN0) s negativními okraji. Po diskusi s lékařskou onkologií, rozhodli jsme se, že nevyžaduje žádnou další adjuvantní terapii. Pokud jde o sledování, intervalové CT vyšetření by měly být použity k vyhodnocení lokální recidivy a vzdálených metastáz na základě rizika recidivy.6 První kontrolní sken jsme získali za 3 měsíce a bylo to normální. V případě vzdálené recidivy se doporučuje chirurgická resekce, stejně jako použití systémové terapie pro ty, kteří nemohou tolerovat operaci.4
prodloužené přežití u pacientů s IVC LMS je možné a vyžaduje multidisciplinární přístup. Chirurgická onkologie a transplantační chirurgie) se doporučuje optimálně řídit a individualizovat léčbu pacientů s touto vzácnou malignitou.
zveřejnění
autoři nemají žádná relevantní zveřejnění.
Prohlášení o souhlasu
pacient uvedený v tomto video článku dal svůj informovaný souhlas s natáčením a je si vědom toho, že informace a obrázky budou zveřejněny online.
citace
- Hollenbeck ST, Grobmyer SR, Kent KC, Brennan MF. Chirurgická léčba a výsledky pacientů s primárním inferiorním leiomyosarkomem vena cava. J Am Sb. 2003; 197 (4): 575-579. doi: 10.1016 / S1072-7515 (03)00433-2.
- Wachtel H, Gupta M, Bartlett EK, et al. Výsledky po resekci leiomyosarkomů dolní duté žíly: souhrnná analýza dat 377 případů. Surg Oncol. 2015;24(1):21-27. doi: 10.1016 / j. suronc.2014.10.007.
- Kieffer E, Alaoui M, Piette JC, Cacoub P, Chiche L. leiomyosarkom dolní duté žíly: zkušenosti ve 22 případech. Ann Surg. 2006; 244 (2): 289-295. diváci: 10.1097 / 01.sla.0000229964.71743.DB.
- Cananzi FCM, Mussi C, Bordoni MG, et al. Úloha chirurgie v multimodální léčbě primárního a rekurentního leiomyosarkomu dolní duté žíly. J Surg Oncol. 2016;114(1):44-49. doi: 10.1002 / jso.24244.
- Ganeshalingam S, Rajeswaran G, Jones RL, Thway K, Moskovic e. Leiomyosarkomy dolní duté žíly: diagnostické rysy při průřezovém zobrazování. Clintonová. 2011;66(1):50-56. doi: 10.1016 / j. crad.2010.08.004.
- Dull BZ, Smith B, Tefera G, Weber s. Surgical management of retroperitoneal leiomyosarcoma arising from the inferior vena cava. J Gastrointest Surg. 2013; 17 (12): 2166-2171. dva: 10.1007 / s11605-013-2385-0.
- Perl L, Virchow R. případ sarkomu dolní dutiny Vena. Archiv patologické Anatomie a fyziologie a klinické medicíny. 1871;53 (4):378-383. doi:10.1007/BF01957198.
- Melchior e.sarkom dolní dutiny Vena. Německý časopis Chirurgie. 1928;213 (1-2): 135-140. doi: 10.1007/BF02796714.
- Mingoli a, Cavallaro a, Sapienza P, di Marzo L, Feldhaus RJ, Cavallari N. Mezinárodní registr dolního vena cava leiomyosarkomu: analýza světové série na 218 pacientech. Anticancer Res. 1996; 16 (5B): 3201-3205.
- Fiore M, Colombo C, Locati P, et al. Chirurgická technika, morbidita a výsledek primárního retroperitoneálního sarkomu zahrnujícího dolní dutou žílu. Ann Surg Oncol. 2012;19(2):511-518. doi: 10.1245 / s10434-011-1954-2.