Abstract
primaire leiomyosarcoomen van de inferieure vena cava (IVC) zijn zeldzame tumoren met complexe anatomische relaties. Chirurgische resectie blijft de primaire aanpak voor de behandeling, met selectief gebruik van preoperatieve bestraling en chemotherapie. Gezien de neiging tot lokale invasie van deze tumoren, radicale resectie van omringende structuren is vaak vereist. Hierin beschrijven we de presentatie, work-up, operatief beheer, en uitkomsten van deze laesies door het geval van een patiënt met een tumor in het midden segment van de IVC. Gezien de mate van betrokkenheid werd IVC-resectie met en bloc rechternefrectomie, rechternierectomie en partiële linker nieraderresectie uitgevoerd met vasculaire reconstructie met behulp van een prothese. Met de juiste preoperatieve planning en een goed gecoördineerde multidisciplinaire aanpak kan agressieve chirurgische resectie veilig worden uitgevoerd en kunnen patiënten profiteren van een gunstige overleving op lange termijn.
Casusoverzicht
Achtergrond
leiomyosarcoom (LMS) van de inferieure vena cava (IVC) is een soms voorkomend neoplasma waarbij de gladde spieren van de ader betrokken zijn.1 de ziekte wordt vaker gezien bij vrouwen (3: 1) in het vijfde levensdecennium.2 Maximale tumordiameter is genoteerd om te variëren tussen 8-37 centimeter.Naast betrokkenheid van de rechternier of bijnier zijn ook directe uitbreiding van de rechter-of linkerlever, infrarenale aorta, intracardiale regio en supradiafragmatische rechterlong waargenomen.In de meeste gevallen krijgen patiënten een preoperatieve histologische diagnose door middel van een percutane biopsie of laparotomie.
gefocuste voorgeschiedenis van patiënt
een 73-jarige vrouw vertoonde een voorgeschiedenis van intermitterende lage rugpijn, zwelling van de onderste ledematen en een gewichtsverlies van zes pond in de loop van een jaar. Haar verleden medische geschiedenis was opmerkelijk voor hypertensie waarvoor zij atenolol, hydrochloorthiazide, en nifedipine evenals reflux nam waarvoor zij op omeprazol werd gehandhaafd. Op workup door haar huisarts, ze ontving een computertomografie (CT) scan van de buik en bekken aantonen van een massa langs de juxtarenal IVC die werd biopsie en Gevonden in overeenstemming met leiomyosarcoom (Fig. 1).
lichamelijk onderzoek
het meest voorkomende symptoom bij patiënten met IVC LMS is buikpijn (59,9%), gevolgd door oedeem in de onderste ledematen (14,8%), gewichtsverlies (11,4%), rugpijn (9,7%) en een opgezette buik (9,3%).1-4 onderste extremiteit oedeem wordt verondersteld om slechts in een fractie van patiënten voor te komen waarschijnlijk toe te schrijven aan de ontwikkeling van veneuze collaterals in de setting van langzame tumorgroei. Veel minder vaak zijn diepe veneuze trombose (1,7%) of het syndroom van Budd-Chiari (1,3%) verantwoordelijk voor de presentatie.1-4 extra tekenen zoals hartritmestoornissen kunnen aanwezig zijn bij patiënten met intracardiale tumoruitbreiding in het rechter atrium. Zoals gezegd, onze patiënt gepresenteerd met een geschiedenis van intermitterende lage rugpijn, onderste ledematen zwelling, en gewichtsverlies. Bij lichamelijk onderzoek was ze echter goed te zien, had ze een zachte, niet-gevoelige buik zonder hepatosplenomegalie, en werd opgemerkt dat ze niet-oedemateuze distale extremiteiten had. Haar examen was anders onopvallend.
beeldvorming
axiale beeldvorming met behulp van CT of magnetic resonance imaging (MRI) vormt de primaire beeldvormingsmodaliteit voor de evaluatie van patiënten met LMS, aangezien deze scans details geven over de omvang van tumor, lokale invasie en ziekte op afstand. Op CT verschijnt LMS van de IVC als een heterogene, niet-verkalkte massa met perifere versterking.5 MRI-beelden zijn opmerkelijk voor lage signaalintensiteit op T1 gewogen beelden en hoge signaalintensiteit op T2 gewogen beelden.5 Een deel van de patiënten kan ook abdominale echografie, waar real-time Doppler kan de mate van vasculaire obstructie en trombose af te bakenen. Hoewel invasieve studies zoals het stijgen of retrograde cavografie en selectieve arteriografie door sommige auteurs zijn bepleit,3 worden zij minder gemeenschappelijk gezien de verhoogde resolutie en reconstructies die door niet-invasieve axiale weergave kunnen worden verkregen. CT-beelden kunnen verder worden verbeterd door vertraagde fase of veneuze fase beelden die het IVC en het resterende stroomlumen beter kunnen afbakenen. Ten slotte, bij patiënten waarbij er bezorgdheid voor intracardiac uitbreiding van tumor, transesophageal echocardiografie preoperatief worden verkregen.
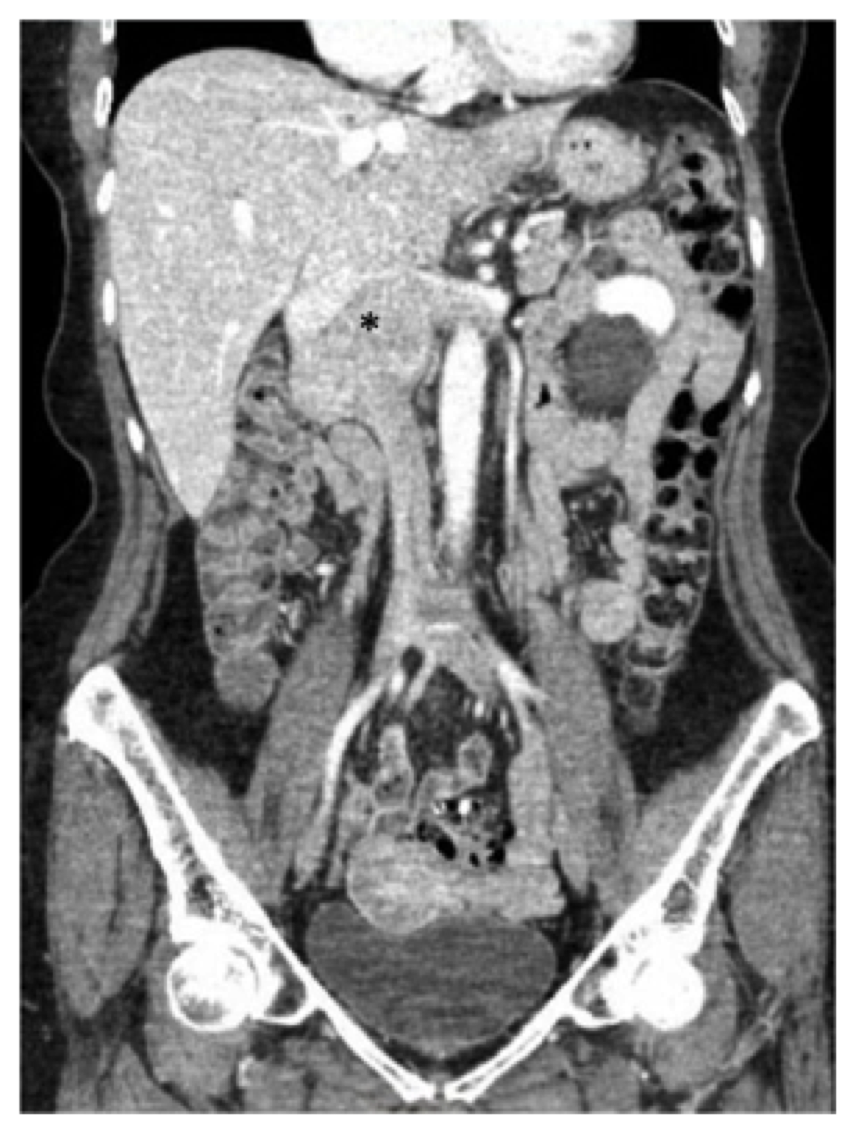 Fig. 1, preoperatieve computertomografie (CT) scan van de buik en het bekken aantonen van de bekende leiomyosarcoom gecentreerd in de infrarenale inferieure vena cava (asterisk), die zich boven het niveau van de hepatische samenvloeiing en lateraal in de renale aderen.
Fig. 1, preoperatieve computertomografie (CT) scan van de buik en het bekken aantonen van de bekende leiomyosarcoom gecentreerd in de infrarenale inferieure vena cava (asterisk), die zich boven het niveau van de hepatische samenvloeiing en lateraal in de renale aderen. de patiënt in dit rapport onderging een CT – scan met contrast van de buik en het bekken, en we merkten een massa van 7,5 cm waarbij het IVC betrokken was, beginnend op het niveau van de renale aders (de rechter nierader was sterk betrokken en er was ook betrokkenheid van de oorsprong van de linker nierader) tot het niveau van – maar niet van-de hepatische aders (Fig. 1). De twaalfvingerige darm en de alvleesklier werden opgemerkt te zijn verplaatst anteriorly zonder bewijs van directe invasie.
natuurlijke voorgeschiedenis
primaire IVC LMS bleek uniform fataal en zonder overleving van 3 jaar bij patiënten die onvolledige resectie kregen.1 uit de gepoolde analyse bleek dat bij patiënten die een chirurgische resectie ondergingen, de 1 – en 5-jaars ziektevrije overleving (DFS) laag was (respectievelijk 57% en 6%). De totale overleving was echter gunstig (respectievelijk 92% en 55%).2
behandelingsopties
volledige chirurgische resectie is de voorkeursbehandeling voor patiënten die een operatie kunnen verdragen en vaak en bloc resectie van betrokken aangrenzende organen noodzakelijk maken. Resectie met ligatie van IVC kan worden uitgevoerd voor infrarenale tumoren of die noodzakelijk resectie van de rechter nier waarin aanzienlijke collaterals voor de linker nier zijn gevormd. Bij ongeveer een kwart van de patiënten kan een gedeeltelijke IVC-resectie worden uitgevoerd.3 Er is gesuggereerd dat als 75% van de omtrek wordt verwijderd, volledige resectie en reconstructie nodig is.6 voor degenen die reconstructie nodig hebben, kan een geringde polytetrafluorethyleen (PTFE) prothese worden aangepast en kan worden gehecht op zijn plaats met een 4-0 of 5-0 polypropyleen hechtdraad. Het gebruik van chemotherapie of radiotherapie als neoadjuvante of adjuvante therapie kan een toenemende rol spelen. Gezien de zeldzaamheid van deze ziekte en het gebrek aan behandelingsuitkomstgegevens tot op heden, zijn deze modaliteiten momenteel afgestemd op elke individuele patiënt na multidisciplinaire discussie, en er is variabiliteit in hun toepassing.
grondgedachte voor behandeling
gezien de zeldzaamheid van primaire IVC LMS, zijn er beperkte studies die een niet-operatieve aanpak ondersteunen, en volledige chirurgische resectie blijft de optimale beheersstrategie.2 in de inspanningen om het risico van herhaling bij de retroperitoneale marge evenals tumor zaaien van de peritoneale holte op het moment van chirurgische resectie te verminderen, onze institutionele praktijk voor het beheer van retroperitoneale sarcoom omvat neoadjuvante bestraling gevolgd door radicale resectie en chemotherapie indien nodig na het beoordelen en bespreken van de uiteindelijke explant pathologie. Specifiek, onze patiënt werd ingeschreven in een National Cancer Institute (NCI) gesponsorde studie (DFCI / HCC 12-100) waarin ze werden behandeld met 63 Gray (Gy) aan de retroperitoneale marge en 50.4 Gy aan het hele tumorgebied met behulp van potloodstraal scannen protonen over vijf weken. De patiënt verdroeg dit goed, had een stabiele re-staging scan, en ging vervolgens verder met radicale resectie van haar retroperitoneaal sarcoom met en bloc resectie van de rechter nier, de rechter bijnier, de inferieure vena cava, en een deel van de linker nierader zoals hieronder beschreven (zie procedure schets).
discussie
de eerste beschrijving van een primair IVC LMS was in 1871 door Perl,7 gevolgd door de eerste resectie door Melchior in 1928 waarbij de patiënt 2 weken na de operatie overleed.8 met verbeteringen die preoperatieve planning mogelijk maken, verfijning van chirurgische techniek en blootstelling, en verbeteringen in kritieke zorg, bedraagt de perioperatieve mortaliteit van 30 dagen na resectie van IVC LMS nu 1,9%.2 Er blijft echter een aanzienlijke morbiditeit van 30 dagen (24,7%).2 niettemin, chirurgische resectie blijft de primaire behandelingsstrategie. Met deze benadering, lange termijn 5-jaar DFS is vastgesteld laag te zijn (6%) terwijl 5-jaar totale overleving gunstig is geweest (55%).2
tot voor kort werd een aantal rapporten in de literatuur over IVC LMS beperkt door kleine steekproefomvang. Een gepoolde analyse door Wachtel et al. heeft de meest uitgebreide studie met 377 patiënten mogelijk gemaakt.2 Na aangepaste analyse werden factoren geïdentificeerd die leidden tot een verminderde totale overleving, waaronder grote tumorgrootte (≥9 cm), hogere leeftijd (≥55 jaar), de noodzaak van en bloc resectie, positieve margestatus, adjuvante chemotherapie en tumorlocatie. Specifiek, primaire IVC leiomyosarcomen zijn geclassificeerd volgens de mate van veneuze betrokkenheid en worden beschreven door de bovengrens van de tumor en de mate van tumoruitbreiding. Met behulp van dit classificatiesysteem zijn segment I tumoren infrarenaal, segment II zijn interrenaal en/of suprarenaal tot maar niet met inbegrip van de suprahepatische aderen, en segment III zijn die welke zich uitstrekken tot de suprahepatische aderen en hebben mogelijke intracardiale uitbreiding. Segment II, of middensegment, tumors zijn het gemeenschappelijkst en zijn gevonden om betere resultaten te hebben dan die die in of segment I of segment III.2,9 voor een deel, wordt dit verondersteld te zijn toe te schrijven aan vroege erkenning van tumoren in Segment II toe te schrijven aan een nauwere anatomische nabijheid van deze tumoren aan veelvoudige organen die tot pijn of obstructie kunnen leiden.2 de tumor van onze patiënt kan het best worden geclassificeerd als een segment II laesie.
enkele opmerkingen over de operationele procedure voor IVC LMS resectie en reconstructie verdienen verdere discussie. Met betrekking tot blootstelling, is een abdominale benadering (mediane laparotomie of rechter subcostale incisie) gebruikt in de meerderheid van de gevallen (60%) terwijl een thoracoabdominale benadering met mogelijke sternotomie kan worden gebruikt afhankelijk van de verschillende anatomie van de tumor wordt verwijderd.3 specifiek, voor tumoren die zich uitstrekken in de retrohepatische of suprahepatische vena cava, totale hepatische uitsluiting door middel van het klemmen van de IVC boven en onder de lever in aanvulling op het klemmen van de poortader nodig kan zijn. Bij patiënten met intracardiale extensie kan een adequate blootstelling nodig zijn om een cardiopulmonale bypass mogelijk te maken. In het algemeen, patiënten met tumoren geïsoleerd aan de infrahepatische en pararenale cava zal waarschijnlijk tolereren volledige cross-clamping van de IVC zonder significante hemodynamische veranderingen, zolang voldoende preload is verzekerd met de juiste intraoperatieve reanimatie door het anesthesieteam. Wat de techniek betreft, wordt bij patiënten met veneuze hypertensie (proximale veneuze druk van 30 mmHg of hoger) reconstructie (in tegenstelling tot ligatie, primaire resectie of cavoplastiek) aanbevolen om postoperatief oedeem van de onderste ledematen te voorkomen.3 bovendien, reimplantatie van de nier of lever aderen kan nodig zijn, afhankelijk van de mate van tumor verwijderd. Er is momenteel geen standaard voor postoperatieve anticoagulatie management, en antiplatelet aspirine therapie, zoals werd gebruikt bij onze patiënt die werd ontslagen op 325 mg aspirine per dag, wordt geassocieerd met lage tarieven van postoperatieve graft trombose.Gerandomiseerde gecontroleerde studies naar de werkzaamheid van chemotherapie of radiotherapie bij de behandeling van IVC LMS mogen nooit gepubliceerd worden vanwege de zeldzaamheid van de ziekte. De eindpathologie van onze patiënt was opmerkelijk voor een graad 2/3 leiomyosarcoom (yPT2bN0) met negatieve marges. Na overleg met medische oncologie, besloten we dat ze geen extra adjuvante therapie nodig had. Wat de follow-up betreft, moeten interval CT-scans worden gebruikt om lokaal recidief en verre metastase te evalueren op basis van het risico op recidief.6 we kregen onze eerste surveillance scan na 3 maanden, en het was normaal. In geval van herhaling op afstand, chirurgische resectie wordt aanbevolen, evenals het gebruik van systemische therapie voor degenen die niet in staat om een operatie te verdragen.Langdurige overleving bij patiënten met IVC LMS is mogelijk en vereist een multidisciplinaire aanpak. Hoewel chirurgie de hoeksteen van de behandeling blijft, wordt de betrokkenheid van medische en radioncologie evenals meerdere chirurgische subspecialiteiten (b.v. chirurgische oncologie en transplantatie chirurgie) aangemoedigd om de behandeling voor patiënten met deze zeldzame maligniteit optimaal te beheren en te individualiseren.
informatieverschaffing
de auteurs hebben geen relevante informatieverschaffing.
Toestemmingsverklaring
de patiënt waarnaar in dit videoartikel wordt verwezen heeft zijn geïnformeerde toestemming gegeven om te worden gefilmd en is zich ervan bewust dat informatie en beelden online zullen worden gepubliceerd.
aanhalingen
- Hollenbeck ST, Grobmyer SR, Kent KC, Brennan MF. Chirurgische behandeling en resultaten van patiënten met primaire inferieure vena cava leiomyosarcoom. J Am Coll Sur. 2003; 197 (4):575-579. doi: 10.1016 / S1072-7515 (03)00433-2.
- Wachtel H, Gupta M, Bartlett EK, et al. Resultaten na resectie van leiomyosarcomen van de inferieure vena cava: een gepoolde gegevensanalyse van 377 gevallen. Surg Oncol. 2015;24(1):21-27. doi: 10.1016 / j.suronc.2014.10.007.
- Kieffer E, Alaoui M, Piette JC, Cacoub P, Chiche L. leiomyosarcoom van de inferieure vena cava: ervaring in 22 gevallen. Ann Sur. 2006; 244 (2):289-295. doi: 10.1097 / 01.sla.0000229964.71743.dB.
- Cananzi FCM, Mussi C, Bordoni MG, et al. Rol van chirurgie in de multimodale behandeling van primair en recidiverend leiomyosarcoom van de inferieure vena cava. J Surg Oncol. 2016;114(1):44-49. doi: 10.1002 / jso.24244.
- Ganeshalingam s, Rajeswaran G, Jones RL, Thway K, Moskovic E. Leiomyosarcomas of the inferior vena cava: diagnostic features on cross-sectional imaging. Clin Radiol. 2011;66(1):50-56. doi: 10.1016 / j.crad.2010.08.004.
- Dull BZ, Smith B, Tefera G, Weber S. Chirurgische behandeling van retroperitoneaal leiomyosarcoom als gevolg van de inferieure vena cava. J Gastrointestinal Surgery 2013; 17 (12): 2166-2171. doi: 10.1007 / s11605-013-2385-0.
- Perl l, Virchow R. Een geval van sarcoom van de inferieure vena cava. Archiv für pathologische Anatomie und Physiologie und für klinische Medicin. 1871;53(4):378-383. doi: 10.1007 / BF01957198.
- Melchior E. sarcoom van de inferieure vena cava. Duitse Journal of Surgery. 1928;213(1-2):135-140. doi: 10.1007 / BF02796714.
- Mingoli a, Cavallaro A, Sapienza P, Di Marzo L, Feldhaus RJ, Cavallari N. International registry of inferior vena cava leiomyosarcoom: analysis of a world series on 218 patients. 1996; 16 (5B): 3201-3205.
- Fiore M, Colombo C, Locati P, et al. Chirurgische techniek, morbiditeit en resultaat van primair retroperitoneaal sarcoom waarbij inferieure vena cava betrokken is. Ann Surg Oncol. 2012;19(2):511-518. doi: 10.1245 / s10434-011-1954-2.