Résumé
Les léiomyosarcomes primaires de la veine cave inférieure (IVC) sont des tumeurs rares avec des relations anatomiques complexes. La résection chirurgicale reste la principale approche de prise en charge, avec l’utilisation sélective de la radiothérapie préopératoire et de la chimiothérapie. Compte tenu de la propension à l’invasion locale de ces tumeurs, une résection radicale des structures environnantes est souvent nécessaire. Ici, nous décrivons la présentation, le bilan, la gestion opératoire et les résultats de ces lésions à travers le cas d’un patient avec une tumeur impliquant le segment médian de l’IVC. Compte tenu de l’étendue de l’atteinte, une résection IVC avec néphrectomie droite en bloc, une surrénalectomie droite et une résection partielle de la veine rénale gauche ont été réalisées avec reconstruction vasculaire à l’aide d’une greffe prothétique. Avec une planification préopératoire appropriée et une approche multidisciplinaire bien coordonnée, une résection chirurgicale agressive peut être réalisée en toute sécurité et les patients peuvent bénéficier d’une survie à long terme favorable.
Aperçu du cas
Contexte
Représentant moins de 0,5 % de tous les sarcomes des tissus mous, le léiomyosarcome (SML) de la veine cave inférieure (CVI) est un néoplasme peu fréquent impliquant le muscle lisse de la veine.1 La maladie est plus fréquente chez les femmes (3:1) au cours de la cinquième décennie de la vie.2 Le diamètre maximal de la tumeur a été noté entre 8 et 37 centimètres.3 En plus de l’atteinte du rein droit ou de la surrénale, une extension directe vers le foie droit ou gauche, l’aorte infrarénale, la région intracardiaque et le poumon droit supradiaphragmatique ont été notés.3 Dans la majorité des cas, les patients reçoivent un diagnostic histologique préopératoire par biopsie percutanée ou laparotomie.3
Antécédents ciblés de la patiente
Une femme de 73 ans présentait des antécédents de douleurs intermittentes au bas du dos, de gonflement des membres inférieurs et de perte de poids de six livres au cours d’une année. Ses antécédents médicaux étaient remarquables pour l’hypertension pour laquelle elle prenait de l’aténolol, de l’hydrochlorothiazide et de la nifédipine, ainsi que pour le reflux pour lequel elle était maintenue sous oméprazole. Après examen par son médecin de soins primaires, elle a reçu une tomodensitométrie (TDM) de l’abdomen et du bassin démontrant une masse le long de la CVI juxtarénale qui a été biopsiée et qui s’est avérée compatible avec le léiomyosarcome (Fig. 1).
Examen physique
Le symptôme le plus courant chez les patients atteints de SML par voie INTRAVEINEUSE est une douleur abdominale (59,9%), suivie d’un œdème des membres inférieurs (14,8%), d’une perte de poids (11,4%), d’un mal de dos (9,7%) et d’une distension abdominale (9,3%).On pense que l’œdème des membres inférieurs 1-4 ne se produit que chez une fraction des patients probablement en raison du développement de collatéraux veineux dans le cadre d’une croissance tumorale lente. Beaucoup moins fréquemment, la thrombose veineuse profonde (1,7%) ou le syndrome de Budd-Chiari (1,3%) sont responsables de la présentation.1 à 4 signes supplémentaires tels qu’une arythmie cardiaque peuvent être présents chez les patients présentant une extension tumorale intracardiaque dans l’oreillette droite. Comme mentionné, notre patient présentait des antécédents de douleurs intermittentes au bas du dos, de gonflement des membres inférieurs et de perte de poids. Lors de l’examen physique, cependant, elle apparaissait bien, avait un abdomen mou et non tendre sans hépatosplénomégalie et avait des extrémités distales non œdémateuses. Son examen était par ailleurs banal.
Imagerie
L’imagerie axiale utilisant la tomodensitométrie ou l’imagerie par résonance magnétique (IRM) constitue la principale modalité d’imagerie pour évaluer les patients présentant un SML car ces analyses fournissent des détails sur l’étendue de la tumeur, l’invasion locale et la maladie distante. Sur CT, le LMS de l’IVC apparaît comme une masse hétérogène, non calcifiée avec amélioration périphérique.5 Les images IRM se distinguent par une intensité de signal faible sur les images pondérées T1 et une intensité de signal élevée sur les images pondérées T2.5 Une partie des patients peut également recevoir une échographie abdominale, où le Doppler en temps réel peut délimiter le degré d’obstruction vasculaire et de thrombose. Bien que des études invasives telles que la cavographie ascendante ou rétrograde et l’artériographie sélective aient été préconisées par certains auteurs3, elles deviennent moins courantes étant donné la résolution et les reconstructions accrues qui peuvent être obtenues par imagerie axiale non invasive. Les images CT peuvent être encore améliorées par des images de phase retardée ou de phase veineuse qui peuvent mieux délimiter la lumière IVC et le flux résiduel. Enfin, chez les patients chez lesquels il existe un souci d’extension intracardiaque de la tumeur, l’échocardiographie transoesophagienne doit être obtenue en préopératoire.
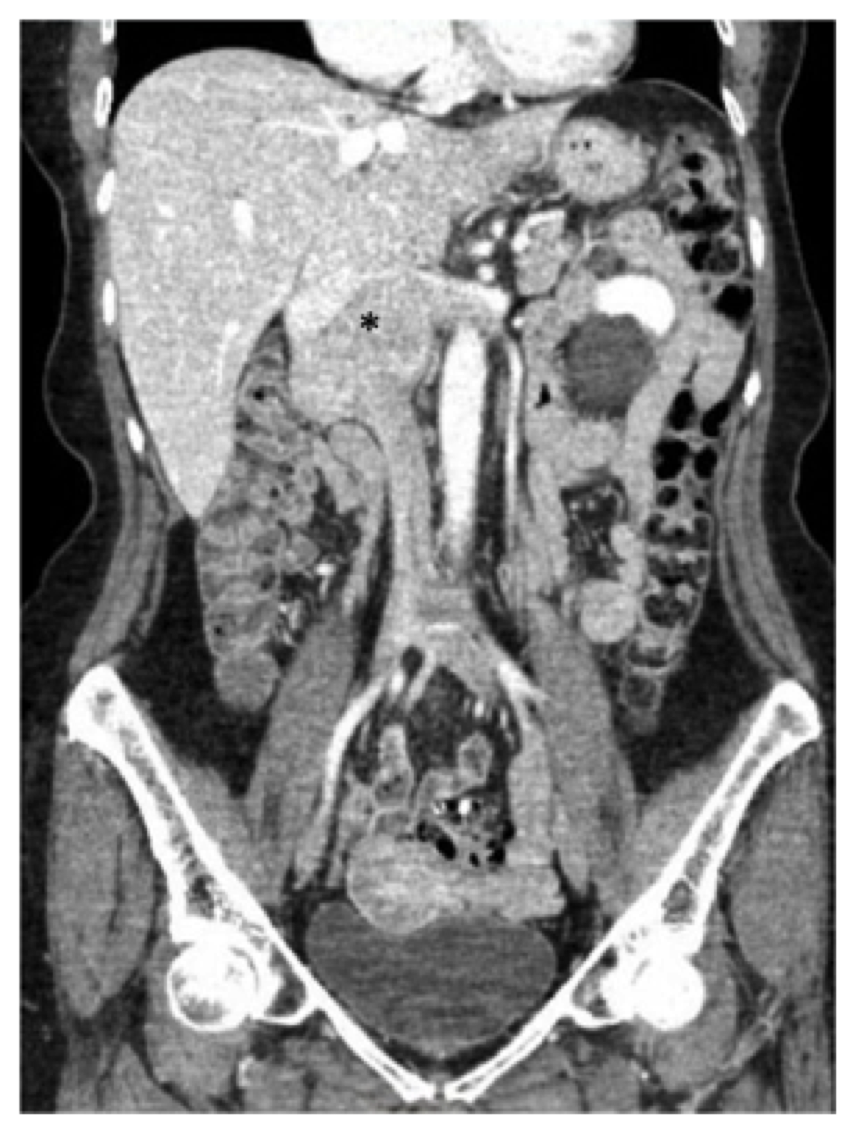 Fig. 1, tomodensitométrie préopératoire (TDM) de l’abdomen et du bassin démontrant le léiomyosarcome connu centré dans la veine cave inférieure infrarénale (astérisque), s’étendant au-dessus du niveau de la confluence hépatique et latéralement dans les veines rénales.
Fig. 1, tomodensitométrie préopératoire (TDM) de l’abdomen et du bassin démontrant le léiomyosarcome connu centré dans la veine cave inférieure infrarénale (astérisque), s’étendant au-dessus du niveau de la confluence hépatique et latéralement dans les veines rénales. Le patient dans ce rapport a subi une tomodensitométrie avec contraste de l’abdomen et du bassin, et nous avons noté une masse de 7,5 cm impliquant l’IVC commençant au niveau des veines rénales (la veine rénale droite était largement impliquée et il y avait également une implication de l’origine de la veine rénale gauche) au niveau des veines hépatiques, mais n’impliquant pas les veines hépatiques (Fig. 1). Le duodénum et le pancréas ont été déplacés antérieurement sans signe d’invasion directe.
Histoire naturelle
Le SMV primaire par voie intraveineuse s’est avéré uniformément mortel et sans survie à 3 ans chez les patients ayant reçu une résection incomplète.1 Lors de l’analyse groupée, chez les patients subissant une résection chirurgicale, la survie sans maladie (SFM) à 1 et 5 ans s’est avérée faible (57% et 6%, respectivement). Cependant, la survie globale a été favorable (92% et 55%, respectivement).2
Options de traitement
La résection chirurgicale complète est le traitement préféré des patients pouvant tolérer une intervention chirurgicale et nécessitant souvent une résection en bloc des organes adjacents impliqués. La résection avec ligature de l’IVC peut être réalisée pour les tumeurs infrarénales ou celles nécessitant une résection du rein droit dans lesquelles des collatéraux substantiels pour le rein gauche se sont formés. Chez environ un quart des patients, une résection IVC partielle peut être réalisée.3 Il a été suggéré que si 75% de la circonférence est enlevée, une résection et une reconstruction complètes sont nécessaires.6 Pour ceux qui nécessitent une reconstruction, une prothèse annelée en polytétrafluoroéthylène (PTFE) peut être dimensionnée pour correspondre et peut être suturée en place avec une suture en polypropylène 4-0 ou 5-0. L’utilisation de la chimiothérapie ou de la radiothérapie comme thérapie néoadjuvante ou adjuvante peut avoir un rôle croissant. Cependant, étant donné la rareté de cette maladie et la rareté des données sur les résultats du traitement disponibles à ce jour, ces modalités sont actuellement adaptées à chaque patient après une discussion multidisciplinaire, et leur application varie.
Justification du traitement
Compte tenu de la rareté du SMV primaire, il existe peu d’études soutenant une approche non opératoire, et la résection chirurgicale complète reste la stratégie de prise en charge optimale.2 Dans le but de diminuer le risque de récidive à la marge rétropéritonéale ainsi que l’ensemencement tumoral de la cavité péritonéale au moment de la résection chirurgicale, notre pratique institutionnelle pour la prise en charge du sarcome rétropéritonéal implique une radiothérapie néoadjuvante suivie d’une résection radicale et d’une chimiothérapie si cela est jugé nécessaire après examen et discussion de la pathologie explante finale. Plus précisément, notre patient a été inscrit à un essai commandité par le National Cancer Institute (NCI) (DFCI / HCC 12-100) dans lequel il a été traité avec 63 Gray (Gy) à la marge rétropéritonéale et 50.4 Gy sur toute la zone tumorale à l’aide de protons de balayage par faisceau de crayon sur cinq semaines. La patiente a bien toléré cela, a subi un examen de remise en état stable et a ensuite procédé à une résection radicale de son sarcome rétropéritonéal avec résection en bloc du rein droit, de la glande surrénale droite, de la veine cave inférieure et d’une partie de la veine rénale gauche, comme détaillé ci-dessous (Voir Schéma de la procédure).
Discussion
La première description d’un SMV primaire a eu lieu en 1871 par Perl7, suivie de la première résection par Melchior en 1928 au cours de laquelle le patient est décédé 2 semaines après l’opération.8 Avec les progrès permettant la planification préopératoire, le raffinement de la technique chirurgicale et de l’exposition, et l’amélioration des soins intensifs, la mortalité périopératoire à 30 jours après résection du SMV IVC est maintenant de 1,9%.2 Cependant, la morbidité à 30 jours demeure importante (24,7 %).2 Néanmoins, la résection chirurgicale reste la principale stratégie de traitement. Avec cette approche, on a constaté que la SFM à long terme à 5 ans était faible (6 %) alors que la survie globale à 5 ans était favorable (55 %).2
Jusqu’à récemment, un certain nombre de rapports dans la littérature étudiant les SML IVC étaient limités par la petite taille des échantillons. Une analyse groupée de Wachtel et coll. a permis l’étude la plus complète comprenant 377 patients.2 Après analyse ajustée, les facteurs identifiés comme conduisant à une diminution de la survie globale comprenaient une grande taille de tumeur (≥9 cm), un âge plus avancé (≥55 ans), la nécessité d’une résection en bloc, un statut de marge positive, une chimiothérapie adjuvante et la localisation de la tumeur. Plus précisément, les léiomyosarcomes IVC primaires sont classés en fonction de l’étendue de l’atteinte veineuse et sont décrits par la limite supérieure de la tumeur et le degré d’extension de la tumeur. En utilisant ce système de classification, les tumeurs du segment I sont infrarénales, le segment II sont interrénales et / ou suprarénales jusqu’aux veines suprahépatiques mais non comprises, et le segment III sont celles qui s’étendent dans les veines suprahépatiques et présentent une extension intracardiaque possible. Les tumeurs du segment II, ou segment moyen, sont les plus courantes et se sont avérées avoir de meilleurs résultats que celles du segment I ou du segment III. 2,9 En partie, on pense que cela est dû à la reconnaissance précoce des tumeurs du segment II en raison d’une proximité anatomique plus étroite de ces tumeurs à plusieurs organes, ce qui peut entraîner une douleur ou une obstruction.2 La tumeur de notre patient pourrait mieux être classée comme une lésion de segment II.
Quelques commentaires concernant la procédure opératoire pour la résection et la reconstruction du SML IVC méritent une discussion plus approfondie. En ce qui concerne l’exposition, une approche abdominale (laparotomie médiane ou incision sous-costale droite) a été utilisée dans la majorité des cas (60%) alors qu’une approche thoracoabdominale avec sternotomie possible peut être utilisée en fonction de l’anatomie distincte de la tumeur à réséquer.3 En particulier, pour les tumeurs s’étendant dans la veine cave rétrohépatique ou suprahépatique, une exclusion hépatique totale par serrage de la CIV au-dessus et au-dessous du foie en plus du serrage de la veine porte peut être nécessaire. Chez les patients présentant une extension intracardiaque, une exposition adéquate pour permettre un pontage cardiopulmonaire peut être justifiée. En général, les patients atteints de tumeurs isolées au cava infrahépatique et pararénal toléreront probablement un clampage croisé complet de l’IVC sans altérations hémodynamiques significatives tant que la précharge adéquate est assurée par une réanimation peropératoire appropriée par l’équipe d’anesthésie. En ce qui concerne la technique, chez les patients souffrant d’hypertension veineuse (pressions veineuses proximales de 30 mmHg ou plus), une reconstruction (par opposition à la ligature, à la résection primaire ou à la cavoplastie) est recommandée pour prévenir l’œdème postopératoire des membres inférieurs.3 De plus, une réimplantation des veines rénales ou hépatiques peut être nécessaire en fonction de l’étendue de la tumeur réséquée. Il n’existe actuellement aucune norme pour la gestion de l’anticoagulation postopératoire, et le traitement par aspirine antiplaquettaire, tel qu’il a été utilisé chez notre patient qui a reçu son congé avec 325 mg d’aspirine par jour, est associé à de faibles taux de thrombose du greffon postopératoire.10
Les essais contrôlés randomisés évaluant l’efficacité de la chimiothérapie ou de la radiothérapie dans la prise en charge du SMV IVC peuvent ne jamais être publiés en raison de la rareté de la maladie. La pathologie finale de notre patient était remarquable pour un léiomyosarcome de grade 2/3 (yPT2bN0) avec des marges négatives. Après discussion avec l’oncologie médicale, nous avons décidé qu’elle ne nécessitait aucun traitement adjuvant supplémentaire. En ce qui concerne le suivi, des tomodensitogrammes à intervalles doivent être utilisés pour évaluer la récurrence locale et les métastases à distance en fonction du risque de récidive.6 Nous avons obtenu notre premier scan de surveillance à 3 mois, et c’était normal. En cas de récidive à distance, une résection chirurgicale est recommandée, de même que l’utilisation d’un traitement systémique pour les personnes incapables de tolérer une opération.4
Une survie prolongée chez les patients atteints de SML par voie intraveineuse est possible et nécessite une approche multidisciplinaire. Bien que la chirurgie reste la pierre angulaire du traitement, l’implication de la médecine et de la radio-oncologie ainsi que de multiples surspécialités chirurgicales (par exemple, l’oncologie chirurgicale et la chirurgie de transplantation) est encouragée pour gérer et individualiser de manière optimale le traitement des patients atteints de cette malignité rare.
Divulgations
Les auteurs n’ont aucune divulgation pertinente.
Déclaration de consentement
Le patient visé dans cet article vidéo a donné son consentement éclairé pour être filmé et est conscient que des informations et des images seront publiées en ligne.
Citations
- Rue Hollenbeck, Grobmyer SR, Kent KC, Brennan MF. Traitement chirurgical et résultats des patients atteints de léiomyosarcome primaire de la veine cave inférieure. J Am Coll Surg. 2003; 197 (4): 575-579. doi: 10.1016/ S1072-7515 (03) 00433-2.
- Wachtel H, Gupta M, Bartlett EK, et al. Résultats après résection de léiomyosarcomes de la veine cave inférieure: une analyse de données regroupées de 377 cas. Surg Oncol. 2015;24(1):21-27. doi: 10.1016/ j. suronc.2014.10.007.
- Kieffer E, Alaoui M, Piette JC, Cacoub P, Chiche L. Léiomyosarcome de la veine cave inférieure: expérience dans 22 cas. Ann Surg. 2006; 244(2): 289-295. doi: 10.1097/01.sla.0000229964.71743.DB.
- Cananzi FCM, Mussi C, Bordoni MG, et al. Rôle de la chirurgie dans le traitement multimodal du léiomyosarcome primaire et récurrent de la veine cave inférieure. J Surg Oncol. 2016;114(1):44-49. doi: 10.1002/jso.24244.
- Ganeshalingam S, Rajeswaran G, Jones RL, Thway K, Moskovic E. Léiomyosarcomes de la veine cave inférieure: caractéristiques diagnostiques sur l’imagerie en coupe transversale. Clin Radiol. 2011;66(1):50-56. doi: 10.1016 / j.crad.2010.08.004.
- Dull BZ, Smith B, Tefera G, Weber S. Surgical management of retropéritoneal leiomyosarcoma arising from the inferior vena cava. J Gastrointest Surg. 2013;17(12):2166-2171. doi:10.1007/s11605-013-2385-0.
- Perl l, Virchow R. Un cas de sarcome de la veine cave inférieure. Archives pour L’Anatomie pathologique et la Physiologie et pour Medicin clinique. 1871;53(4):378-383. doi:10.1007/BF01957198.
- Melchior E. Sarcome de la Veine cave inférieure. Revue allemande de Chirurgie. 1928; 213(1-2):135-140. doi:10.1007/BF02796714.
- Mingoli A, Cavallaro A, Sapienza P, Di Marzo L, Feldhaus RJ, Cavallari N. Registre international du léiomyosarcome de la veine cave inférieure: analyse d’une série mondiale sur 218 patients. Anticancer Res. 1996; 16 (5B): 3201-3205.
- Fiore M, Colombo C, Locati P, et al. Technique chirurgicale, morbidité et résultat du sarcome rétropéritonéal primaire impliquant la veine cave inférieure. Ann Surg Oncol. 2012;19(2):511-518. doi: 10.1245/s10434-011-1954-2 .