Streszczenie
pierwotne mięśniakomięsaki żyły głównej dolnej (IVC) są rzadkimi guzami o złożonych związkach anatomicznych. Resekcja chirurgiczna pozostaje podstawowym podejściem do zarządzania, z selektywnym zastosowaniem przedoperacyjnego promieniowania i chemioterapii. Biorąc pod uwagę skłonność do lokalnej inwazji tych guzów, radykalna resekcja otaczających struktur jest często wymagane. Tutaj opisujemy prezentację, pracę, postępowanie operacyjne i wyniki tych zmian w przypadku pacjenta z guzem obejmującym środkowy segment IVC. Ze względu na stopień zaangażowania wykonano resekcję IVC z nefrektomią en bloc prawej, adrenalektomią prawej i częściową resekcją lewej żyły nerkowej z rekonstrukcją naczyniową z użyciem protezy. Dzięki odpowiedniemu planowaniu przedoperacyjnemu i dobrze skoordynowanemu podejściu multidyscyplinarnemu można bezpiecznie wykonać agresywną resekcję chirurgiczną, a pacjenci mogą korzystać z korzystnego długoterminowego przeżycia.
opis przypadku
Tło
reprezentujący mniej niż 0,5% wszystkich mięsaków tkanek miękkich, mięśniakomięsak (LMS) żyły głównej dolnej (IVC) jest niezbyt częstym nowotworem obejmującym mięsień gładki żyły.1 choroba występuje częściej u kobiet (3:1) w piątej dekadzie życia.2 Maksymalna średnica guza odnotowano w zakresie od 8-37 centymetrów.3 oprócz zajęcia prawej nerki lub nadnerczy, odnotowano bezpośrednie przedłużenie do prawej lub lewej wątroby, aorty poduszkowej, regionu wewnątrzsercowego i nadradiafragmatycznego prawego płuca.W większości przypadków pacjenci otrzymują przedoperacyjną diagnozę histologiczną poprzez biopsję przezskórną lub laparotomię.3
skoncentrowana historia pacjenta
73-letnia kobieta z przerywanym bólem w dolnej części pleców, obrzękiem kończyn dolnych i utratą wagi w ciągu roku. Jej historia medyczna była znana z nadciśnienia, na które przyjmowała atenolol, hydrochlorotiazyd i nifedypinę, a także refluks, na który utrzymywała omeprazol. Po zbadaniu przez lekarza podstawowej opieki zdrowotnej otrzymała tomografię komputerową (CT) brzucha i miednicy wykazującą masę wzdłuż przeciwstawnego IVC, która została poddana biopsji i okazała się zgodna z mięśniakomięsakiem lejkowatym (Fig. 1).
badanie fizykalne
najczęstszym objawem u pacjentów z LMS IVC jest ból brzucha (59,9%), następnie obrzęk kończyn dolnych (14,8%), utrata masy ciała (11,4%), ból pleców (9,7%) i wzdęcie brzucha (9,3%).Uważa się, że 1-4 obrzęk kończyn dolnych występuje tylko u części pacjentów, prawdopodobnie z powodu rozwoju zabezpieczeń żylnych w Warunkach powolnego wzrostu guza. Znacznie rzadziej za prezentację odpowiada zakrzepica żył głębokich (1,7%) lub zespół Budda-Chiariego (1,3%).1-4 dodatkowe objawy, takie jak arytmia serca mogą być obecne u pacjentów z wewnątrzsercowym rozszerzeniem guza do prawego przedsionka. Jak wspomniano, nasz pacjent przedstawił historię przerywany ból w dolnej części pleców, obrzęk kończyn dolnych i utrata masy ciała. Na badaniu fizykalnym była jednak dobrze widoczna, miała miękki, nietolerowany brzuch bez hepatosplenomegalii i zauważono, że ma nieedematowe dystalne kończyny. Jej egzamin był poza tym nijaki.
obrazowanie
obrazowanie osiowe przy użyciu CT lub rezonansu magnetycznego (MRI) stanowi podstawowy sposób obrazowania dla oceny pacjentów z LMS, ponieważ te skany dostarczają szczegółów na temat stopnia guza, lokalnej inwazji i odległej choroby. Na CT LMS IVC pojawia się jako niejednorodna, nie zwapniona masa z obwodowym wzmocnieniem.5 obrazy MRI wyróżniają się niskim natężeniem sygnału na obrazach ważonych T1 i wysokim natężeniem sygnału na obrazach ważonych T2.5 część pacjentów może również otrzymać USG jamy brzusznej, gdzie w czasie rzeczywistym Doppler może określić stopień niedrożności naczyń i zakrzepicy. Chociaż badania inwazyjne,takie jak wstępująca lub wsteczna cavografia i selektywna arteriografia były zalecane przez niektórych autorów, 3 stają się one coraz mniej powszechne, biorąc pod uwagę zwiększoną rozdzielczość i rekonstrukcje, które można uzyskać poprzez nieinwazyjne obrazowanie osiowe. Obrazy CT mogą być dodatkowo wzmocnione przez obrazy fazy opóźnionej lub fazy żylnej, które mogą lepiej określić IVC i resztkowe światło przepływu. Wreszcie, u pacjentów, u których istnieje obawa o rozszerzenie wewnątrzsercowe guza, echokardiografia przełyku powinna być wykonywana przedoperacyjnie.
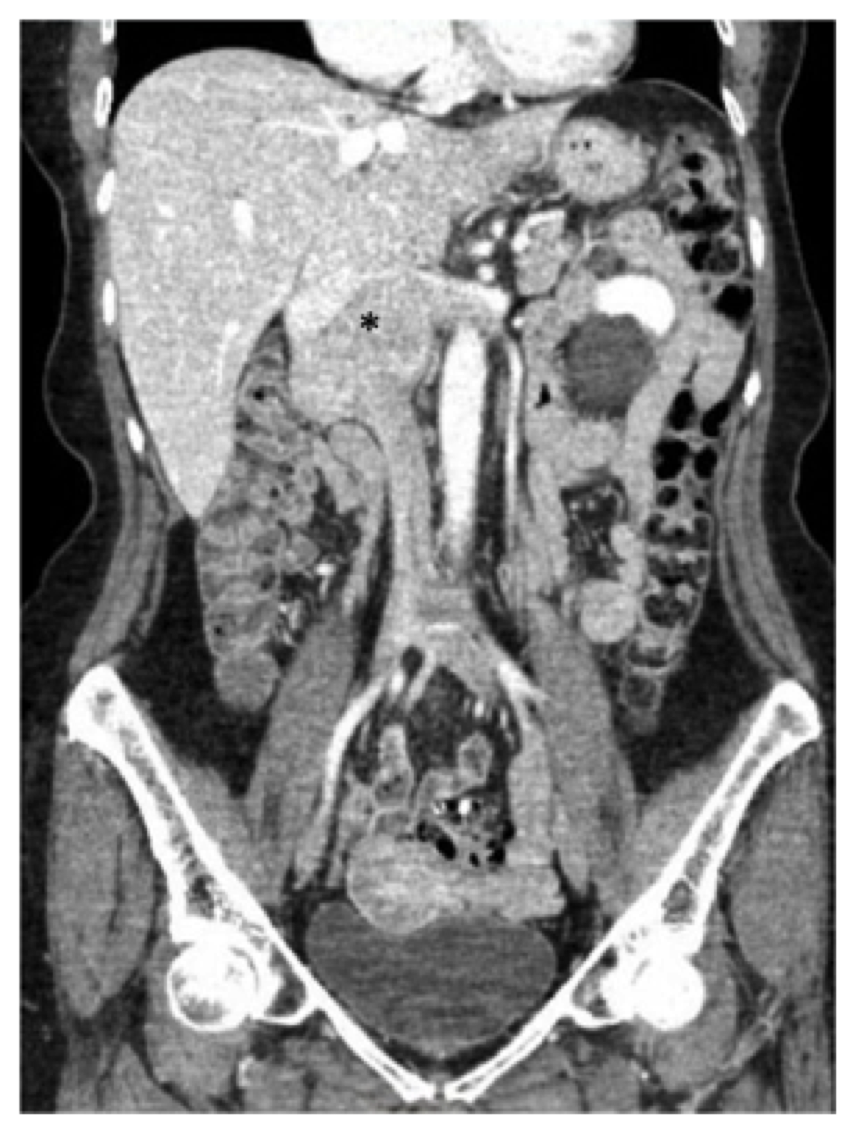 rys. 1, przedoperacyjna tomografia komputerowa (CT) skanowanie brzucha i miednicy wykazujące znany mięśniakomięsak leiomyosarcoma wyśrodkowany w podczerwieni żyły głównej dolnej (gwiazdka), rozciągający się nadrzędnie do poziomu zbiegu wątrobowego i poprzecznie do żył nerkowych.
rys. 1, przedoperacyjna tomografia komputerowa (CT) skanowanie brzucha i miednicy wykazujące znany mięśniakomięsak leiomyosarcoma wyśrodkowany w podczerwieni żyły głównej dolnej (gwiazdka), rozciągający się nadrzędnie do poziomu zbiegu wątrobowego i poprzecznie do żył nerkowych. pacjent w tym raporcie przeszedł tomografię komputerową z kontrastem brzucha i miednicy, a my zauważyliśmy masę 7,5 cm obejmującą IVC, począwszy od poziomu żył nerkowych (prawa żyła nerkowa była w znacznym stopniu zaangażowana, a także było zaangażowanie pochodzenia lewej żyły nerkowej)do poziomu – ale nie obejmującego-żył wątrobowych (ryc. 1). Dwunastnica i trzustka zostały przesunięte przednio bez dowodów bezpośredniej inwazji.
Historia naturalna
pierwotny LMS IVC okazał się jednolicie śmiertelny i bez 3-letniego przeżycia u pacjentów, którzy otrzymali niekompletną resekcję.1 w analizie zbiorczej, u pacjentów poddawanych resekcji chirurgicznej stwierdzono, że 1 – i 5-letnie przeżycie bez choroby (DFS) jest niskie (odpowiednio 57% i 6%). Jednak całkowite przeżycie było korzystne (odpowiednio 92% i 55%).
opcje leczenia
całkowita resekcja chirurgiczna jest preferowanym leczeniem u pacjentów, którzy tolerują operację i często wymagają resekcji en bloc zaangażowanych sąsiednich narządów. Resekcja z podwiązaniem IVC może być wykonywana dla guzów podczerwieni lub tych wymagających resekcji prawej nerki, w których powstały znaczne zabezpieczenia dla lewej nerki. U około jednej czwartej pacjentów można wykonać częściową resekcję IVC.3 zasugerowano, że w przypadku usunięcia 75% obwodu konieczna jest całkowita resekcja i rekonstrukcja.6 dla osób wymagających rekonstrukcji, pierścieniowa proteza politetrafluoroetylenowa (PTFE) może być dopasowana do rozmiaru i może być zszyta na miejscu za pomocą szwu polipropylenowego 4-0 lub 5-0. Zastosowanie chemioterapii lub radioterapii jako terapii neoadiuwantowej lub adiuwantowej może mieć coraz większą rolę. Jednak biorąc pod uwagę rzadkość tej choroby i brak dostępnych do tej pory danych na temat wyników leczenia, sposoby te są obecnie dostosowane do każdego pacjenta po wielodyscyplinarnej dyskusji i istnieje zmienność w ich stosowaniu.
uzasadnienie leczenia
biorąc pod uwagę rzadkość pierwotnego LMS IVC, istnieją ograniczone badania potwierdzające podejście nieoperacyjne, a pełna resekcja chirurgiczna pozostaje optymalną strategią zarządzania.2 w wysiłkach na rzecz zmniejszenia ryzyka nawrotu na marginesie zaotrzewnowym, jak również wysiewu nowotworu jamy otrzewnowej w czasie resekcji chirurgicznej, nasza praktyka instytucjonalna w leczeniu mięsaka zaotrzewnowego obejmuje neoadiuwantową radioterapię, a następnie radykalną resekcję i chemioterapię, jeśli uzna to za konieczne po przeglądzie i omówieniu ostatecznej patologii eksplant. W szczególności, nasz pacjent został zapisany do badania sponsorowanego przez National Cancer Institute (NCI) (dfci/HCC 12-100), w którym byli leczeni 63 szarymi (Gy) do marginesu zaotrzewnowego i 50.4 Gy do całego obszaru guza za pomocą wiązki ołówka skanowania protonów w ciągu pięciu tygodni. Pacjentka dobrze to tolerowała, miała stabilny skan, a następnie przystąpiła do radykalnej resekcji mięsaka zaotrzewnowego z wycięciem prawej nerki, prawego nadnercza, żyły głównej dolnej i części lewej żyły nerkowej, jak opisano poniżej (Patrz zarys procedury).
dyskusja
pierwszy opis pierwotnego LMS IVC został opisany w 1871 roku przez Perla,7, a następnie pierwsza resekcja przez Melchiora w 1928 roku, w której pacjent zmarł 2 tygodnie po operacji.8 dzięki postępowi pozwalającemu na planowanie przedoperacyjne, udoskonalenie techniki chirurgicznej i ekspozycji oraz poprawę opieki krytycznej, 30-dniowa śmiertelność okołooperacyjna po resekcji LMS IVC wynosi obecnie 1,9%.2 pozostaje jednak znaczna 30-dniowa zachorowalność (24,7%).2 niemniej jednak, resekcja chirurgiczna pozostaje podstawową strategią leczenia. Dzięki takiemu podejściu długoterminowy 5-letni DFS został zauważony jako niski (6%), podczas gdy 5-letnie całkowite przeżycie było korzystne (55%).2
do niedawna liczba doniesień w literaturze badającej LMS IVC była ograniczona przez niewielkie rozmiary próbek. Zbiorcza analiza przez Wachtel et al. pozwoliło na przeprowadzenie najbardziej kompleksowego badania obejmującego 377 pacjentów.2 Po SKORYGOWANEJ analizie, czynniki zidentyfikowane jako prowadzące do zmniejszenia całkowitego przeżycia obejmowały duży rozmiar guza (≥9 cm), starszy wiek (≥55 lat), konieczność resekcji en bloc, dodatni status marginesu, chemioterapię uzupełniającą i lokalizację guza. Konkretnie, pierwotne IVC leiomyosarcomas są klasyfikowane w zależności od stopnia zaangażowania żylnego i są opisane przez górną granicę guza i stopień rozszerzenia guza. Stosując ten system klasyfikacji, guzy segmentu I są infrarenalne, segment II są międzyrenalne i / lub nadrenalne do żył nadwątrobowych, ale nie wliczając, a segment III to te, które rozciągają się do żył nadwątrobowych i mają możliwe rozszerzenie wewnątrzsercowe. Segment II lub środkowy segment, guzy są najbardziej powszechne i okazały się mieć lepsze wyniki niż te pojawiające się w obu segmencie I lub segmencie III. 2,9 w części uważa się, że jest to spowodowane wczesnym rozpoznaniem guzów w segmencie II ze względu na bliższą anatomiczną bliskość tych guzów do wielu narządów, co może prowadzić do bólu lub niedrożności.2 guz naszego pacjenta najlepiej zaklasyfikować jako uszkodzenie w segmencie II.
kilka uwag dotyczących procedury operacyjnej resekcji i rekonstrukcji IVC LMS wymaga dalszej dyskusji. Jeśli chodzi o ekspozycję, w większości przypadków (60%) zastosowano podejście brzuszne (mediana laparotomii lub prawe nacięcie podżebrowe), podczas gdy podejście torakoabdominalne z możliwą sternotomią może być zastosowane w zależności od odrębnej anatomii wyciętego guza.W szczególności, w przypadku nowotworów rozszerzających się do żyły głównej retrohepatycznej lub nadwątrobowej, konieczne może być całkowite wykluczenie wątroby poprzez zaciskanie IVC powyżej i poniżej wątroby, oprócz zaciskania żyły wrotnej. U pacjentów z przedłużeniem czynności serca może być wymagana odpowiednia ekspozycja umożliwiająca obejście krążenia i oddychania. Ogólnie rzecz biorąc, pacjenci z nowotworami wyizolowanymi z cava infraheepatic i pararenal będą prawdopodobnie tolerować całkowite zaciskanie krzyżowe IVC bez znaczących zmian hemodynamicznych, o ile zapewnione zostanie odpowiednie obciążenie wstępne przy odpowiedniej śródoperacyjnej resuscytacji przez zespół anestezjologiczny. W odniesieniu do techniki, u pacjentów z nadciśnieniem żylnym (proksymalne ciśnienie żylne 30 mmHg lub większe) zaleca się rekonstrukcję (w przeciwieństwie do podwiązania, pierwotnej resekcji lub cavoplastyki) w celu zapobiegania pooperacyjnemu obrzękowi kończyn dolnych.Ponadto, w zależności od stopnia wycięcia guza, może być konieczne ponowne wszczepienie żył nerkowych lub wątrobowych. Obecnie nie ma standardu pooperacyjnego leczenia przeciwzakrzepowego, a przeciwpłytkowa terapia aspiryną, stosowana u naszego pacjenta, który został wypisany na 325 mg aspiryny dziennie, wiąże się z niskim wskaźnikiem pooperacyjnej zakrzepicy przeszczepu.10
randomizowane, kontrolowane badania oceniające skuteczność chemioterapii lub radioterapii w leczeniu IVC LMS mogą nigdy nie zostać opublikowane ze względu na rzadkość choroby. Ostateczna patologia naszego pacjenta była zauważalna dla leiomyosarcoma stopnia 2/3 (yPT2bN0) z ujemnymi marginesami. Po dyskusji z medyczną onkologią stwierdziliśmy, że nie wymaga żadnej dodatkowej terapii adiuwantowej. W odniesieniu do obserwacji po zakończeniu leczenia, w celu oceny nawrotu miejscowego i przerzutów odległych w oparciu o ryzyko nawrotu należy zastosować interwałowe badania tomograficzne.6 otrzymaliśmy nasz pierwszy skan inwigilacyjny po 3 miesiącach i było to normalne. W przypadku nawrotu odległego zaleca się resekcję chirurgiczną, podobnie jak stosowanie terapii ogólnoustrojowej u osób niezdolnych do tolerowania operacji.4
możliwe jest wydłużenie czasu przeżycia u pacjentów z LMS IVC i wymaga wielodyscyplinarnego podejścia. Chociaż chirurgia pozostaje podstawą leczenia, zachęca się do zaangażowania onkologii medycznej i radiacyjnej, a także wielu subspecjalności chirurgicznych (np. Chirurgii Onkologicznej i Transplantacyjnej), aby optymalnie zarządzać i indywidualizować leczenie pacjentów z tym rzadkim nowotworem złośliwym.
ujawnienia
autorzy nie mają istotnych ujawnień.
Oświadczenie o wyrażeniu zgody
pacjent, o którym mowa w tym artykule wideo, wyraził świadomą zgodę na filmowanie i jest świadomy, że informacje i zdjęcia zostaną opublikowane w Internecie.
Cytaty
- Hollenbeck ST, Grobmyer SR, Kent KC, Brennan MF. Leczenie operacyjne i wyniki leczenia pacjentów z pierwotną żyłą główną dolną leiomyosarcoma. J Am Coll. 2003;197 (4): 575-579. doi: 10.1016 / S1072-7515(03)00433-2.
- Wachtel H, Gupta M, Bartlett EK, et al. Wyniki po wycięciu mięśniakomięsaków żyły głównej dolnej: zbiorcza analiza danych z 377 przypadków. Surg Oncol. 2015;24(1):21-27. doi: 10.1016 / j.suronc.2014.10.007.
- Kieffer e, Alaoui M, Piette JC, Cacoub P, Chiche L. Leiomyosarcoma of the inferior vena cava: doświadczenie w 22 przypadkach. Ann Surg. 2006;244(2):289-295. doi: 10.1097/01.sla.0000229964.71743.db.
- Cananzi FCM, Mussi C, Bordoni MG, et al. Rola chirurgii w multimodalnym leczeniu pierwotnego i nawrotowego mięśniakomięsaka żyły głównej dolnej. J Surg Oncol. 2016;114(1):44-49. doi: 10.1002 / jso.24244.
- Ganeshalingam S, Rajeswaran G, Jones RL, Thway K, Moskovic E. Leiomyosarcomas of the inferior vena cava: diagnostic features on cross-sectional imaging. Clin Radiol. 2011;66(1):50-56. doi: 10.1016 / j.crad.2010.08.004.
- Dull BZ, Smith B, Tefera G, Weber S. Surgical management of zaotrzewnowego leiomyosarcoma from the inferior vena cava. J Gastrointest Surg. 2013;17(12):2166-2171. doi:10.1007/s11605-013-2385-0.
- Perl L, R. Virchow przypadek mięsaka vena cava inferior. Archiwum anatomii patologicznej i fizjologii oraz medycyny klinicznej. 1871;53(4):378-383. doi:10.1007/BF01957198.
- Melchior E. mięsak żyły głównej dolnej. Niemiecki dziennik chirurgii. 1928;213(1-2):135-140. doi:10.1007/BF02796714.
- Mingoli a, Cavallaro a, Sapienza P, Di Marzo L, RJ pole dom, Cavallari N. International registry of inferior vena cava leiomyosarcoma: analysis of a world series on 218 patients. Anticancer Res. 1996;16(5B):3201-3205.
- Fiore M, Colombo C, Locati P, et al. Technika chirurgiczna, zachorowalność i wynik pierwotnego mięsaka zaotrzewnowego z udziałem żyły głównej dolnej. Ann Surg Oncol. 2012;19(2):511-518. doi: 10.1245 / s10434-011-1954-2.