Abstrakti
alaonttolaskimon (IVC) primaariset leiomyosarkoomat ovat harvinaisia kasvaimia, joilla on monimutkaisia anatomisia suhteita. Kirurginen resektio on edelleen ensisijainen lähestymistapa hallintaan, selektiivinen käyttö preoperatiivinen säteily ja kemoterapia. Koska taipumus paikallisen invaasion näiden kasvainten, radikaali resektio ympäröivien rakenteiden on usein tarpeen. Tässä kuvataan esitys, työ-up, operatiivinen hallinta, ja tulokset näiden vaurioiden kautta potilaan kasvain, johon keskellä segmentti IVC. Kun otetaan huomioon osallistumisen laajuus, IVC-resektio, jossa oli yhtenä kokonaisuutena oikea nefrektomia, oikea adrenalektomia ja osittainen vasemman munuaislaskimon resektio, tehtiin verisuonten rekonstruktiolla proteesin avulla. Sopivalla preoperatiivisella suunnittelulla ja hyvin koordinoidulla monitieteisellä lähestymistavalla aggressiivinen kirurginen resektio voidaan suorittaa turvallisesti ja potilaat voivat hyötyä suotuisasta eloonjäämisestä pitkällä aikavälillä.
Tapauskatsaus
Tausta
edustaa alle 0, 5%: a pehmytkudossarkoomista, alaonttolaskimon leiomyosarkooma (LMS) on melko harvinainen kasvain, johon liittyy laskimon sileä lihas.1 tauti on yleisempää naisilla (3:1) viidennellä vuosikymmenellä elämän.2 kasvaimen Maksimihalkaisijan on todettu vaihtelevan 8-37 senttimetrin välillä.3 lisäksi osallistuminen oikean munuaisen tai lisämunuaisen, suora laajennus oikeaan tai vasempaan maksaan, infrapuna aortan, intrakardiaalinen alue, ja supradiafragmaattinen oikea keuhko on havaittu.3 useimmissa tapauksissa potilaat saavat ennen leikkausta histologisen diagnoosin joko perkutaanisen biopsian tai laparotomian avulla.3
fokusoitu potilas
73-vuotias nainen, jolla oli esiintynyt ajoittaista alaselkäkipua, alaraajaturvotusta ja kuuden kilon painonlasku vuoden aikana. Hänen aiempi sairaushistoriansa oli huomattava hypertensiossa, johon hän otti atenololia, hydroklooritiatsidia ja nifedipiiniä, sekä refluksitaudissa, johon hän säilyi omepratsolilla. Kun workup hänen primary care lääkäri, hän sai tietokonetomografia (CT) skannaus vatsan ja lantion osoittaa massa pitkin jukstareenaalinen IVC, joka oli biopsied ja todettu olevan yhdenmukainen leiomyosarkooma (Kuva. 1).
fyysinen tentti
yleisin ilmenevä oire potilailla, joilla on laskimonsisäinen LMS, on vatsakipu (59, 9%), seuraavaksi alaraajaödeema (14, 8%), painon lasku (11, 4%), selkäkipu (9, 7%) ja vatsan turvotus (9, 3%).1-4 Alaraajaödeema uskotaan esiintyvän vain murto-osalla potilaista todennäköisesti johtuen laskimoiden vakuuksien kehittymisestä hitaan kasvaimen kasvun asettamisessa. Paljon harvemmin esiintymisestä ovat vastuussa syvä laskimotukos (1,7%) tai Budd-Chiarin oireyhtymä (1,3%).1-4 muita merkkejä, kuten sydämen rytmihäiriö voi olla läsnä potilailla, joilla intrakardiaalinen kasvain laajennus oikeaan eteiseen. Kuten mainittiin, potilaallamme on ollut ajoittaista alaselkäkipua, alaraajaturvotusta ja laihtumista. Fyysisessä tutkimuksessa hän kuitenkin esiintyi hyvin, hänellä oli pehmeä, ei-arka vatsa ilman hepatosplenomegaliaa ja hänellä todettiin ei-edematoottiset distaaliset raajat. Hänen kokeensa oli muuten mitätön.
kuvantaminen
aksiaalinen kuvantaminen käyttäen CT-tai magneettikuvausta (MK) on ensisijainen kuvantamistapa arvioitaessa potilaita, joilla on LMS, koska nämä kuvat antavat tietoja kasvaimen laajuudesta, paikallisesta invaasiosta ja kaukaisesta sairaudesta. CT: ssä IVC: n LMS esiintyy heterogeenisenä, kalkkeutumattomana massana, jolla on perifeerinen lisälaite.5 MRI-kuvat ovat merkittäviä alhaisen signaalin intensiteetin T1-painotetuissa kuvissa ja korkean signaalin intensiteetin T2-painotetuissa kuvissa.5 osa potilaista voi myös saada vatsan ultraääni, jossa reaaliaikainen Doppler voi määrittää aste verisuonten tukos ja tromboosi. Vaikka invasiivisia tutkimuksia,kuten nouseva tai retrograde cavography ja selektiivinen arteriografia on kannattanut jotkut kirjoittajat, 3 ne ovat yhä harvinaisempia, koska lisääntynyt resoluutio ja rekonstruktioita, jotka voidaan saada kautta noninvasive aksiaalinen kuvantaminen. TT-kuvia voidaan edelleen parantaa viivästyneen vaiheen tai laskimovaiheen kuvilla, jotka voivat paremmin rajata IVC: n ja jäännösvirtauksen lumenia. Lopuksi, potilailla, joilla on huolta intrakardiaalisen laajentaminen kasvain, transesofageaalinen kaikukardiografia on otettava ennen leikkausta.
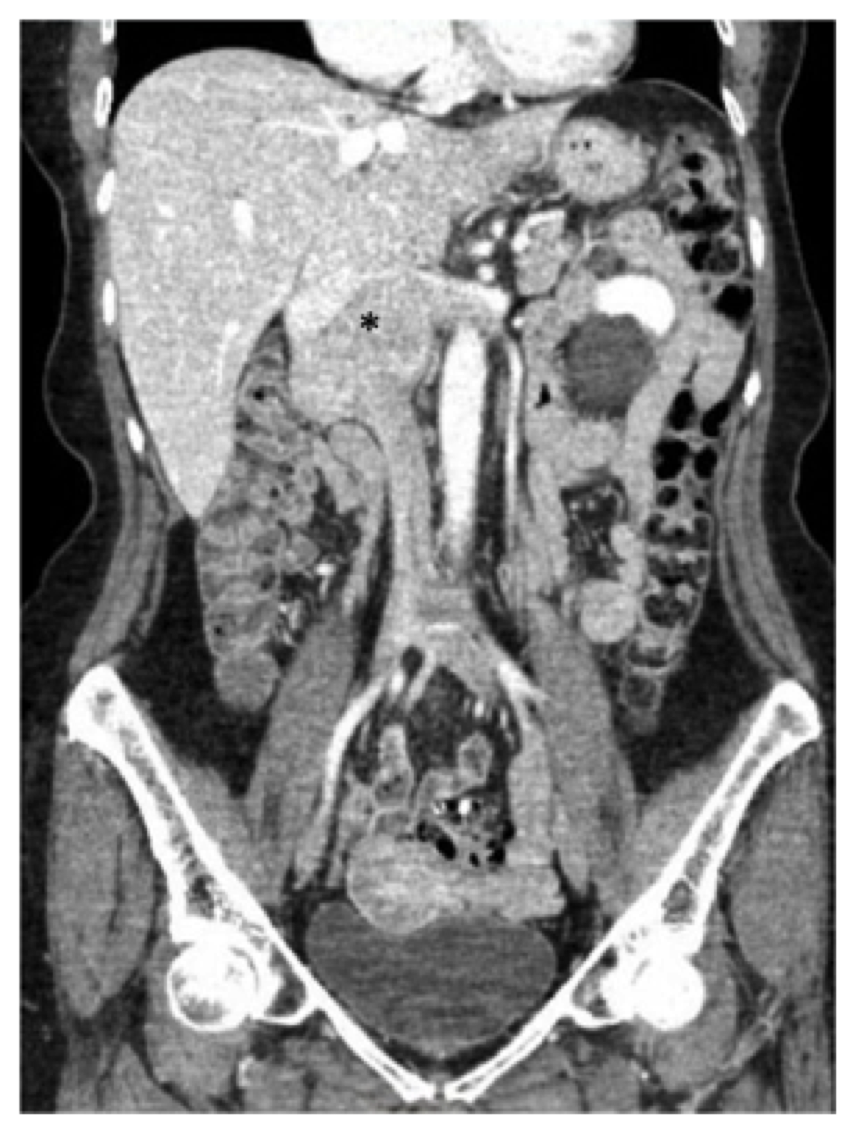 Kuva. 1, preoperative tietokonetomografia (CT) scan vatsan ja lantion osoittaa tiedossa leiomyosarkooma keskitetty infrarenal huonompi Alaonttolaskimo (asteriski), ulottuu superiorly tasolle maksan yhtymäkohtaa ja lateraalisesti osaksi munuaisten laskimot.
Kuva. 1, preoperative tietokonetomografia (CT) scan vatsan ja lantion osoittaa tiedossa leiomyosarkooma keskitetty infrarenal huonompi Alaonttolaskimo (asteriski), ulottuu superiorly tasolle maksan yhtymäkohtaa ja lateraalisesti osaksi munuaisten laskimot. tämän raportin potilaalle tehtiin CT-kuvaus vatsan ja lantion kontrastilla, ja havaitsimme 7, 5 cm: n massan, johon sisältyi laskimonsisäinen LASKIMOTASO, joka alkoi munuaislaskimoiden tasolta (oikea munuaislaskimo oli laajalti mukana ja myös vasemman munuaislaskimon alkuperä oli mukana), joka oli – mutta ei ollut mukana – maksalaskimoiden tasolla (kuva. 1). Pohjukaissuolen ja haiman todettiin siirtyneen toisaalle ilman todisteita suorasta hyökkäyksestä.
Natural History
Primary IVC LMS on todettu tasaisesti kuolemaan johtaneeksi ja ilman 3 vuoden elinaikaa potilailla, jotka saivat epätäydellisen resektion.1 yhdistetyn analyysin perusteella potilailla, joille tehtiin kirurginen resektio, 1-ja 5-vuotisen taudista vapaan eloonjäämisen (DFS) on todettu olevan vähäistä (57% ja 6%). Kokonaiselinaika on kuitenkin ollut suotuisa (92% ja 55%).2
hoitovaihtoehdot
täydellinen kirurginen resektio on suositeltava hoito potilaille, jotka sietävät leikkausta ja vaativat usein vierekkäisten elinten kokonaisresektiota. Resektio ligation IVC voidaan suorittaa infrapuna kasvaimia tai ne edellyttävät resektio oikean munuaisen, jossa merkittäviä vakuuksia vasemman munuaisen ovat muodostuneet. Noin neljäsosalle potilaista voidaan suorittaa osittainen IVC-resektio.3 on ehdotettu, että jos 75% kehästä on poistettu, täydellinen resektio ja jälleenrakentaminen on tarpeen.6 niille, jotka tarvitsevat rekonstruktiota, rengastettu polytetrafluorieteeni (PTFE) proteesi voidaan mitoittaa vastaamaan ja se voidaan ommella paikalleen 4-0 tai 5-0 polypropeeni ommel. Solunsalpaajahoidon tai sädehoidon käyttö joko neoadjuvanttina tai liitännäishoitona voi olla lisääntyvässä roolissa. Ottaen kuitenkin huomioon tämän sairauden harvinaisuuden ja tähänastisten hoitotuloksia koskevien tietojen vähäisyyden, nämä menettelytavat räätälöidään tällä hetkellä kullekin yksittäiselle potilaalle monitieteisen keskustelun jälkeen, ja niiden soveltaminen vaihtelee.
hoidon perusteet
kun otetaan huomioon primaarisen laskimonsisäisen LMS: n harvinaisuus, ei-operatiivista lähestymistapaa tukevia tutkimuksia on rajallisesti, ja täydellinen kirurginen resektio on edelleen optimaalinen hoitostrategia.2 pyrkimyksissä vähentää uusiutumisen riskiä retroperitoneaalisella marginaalilla sekä kasvaimen kylvöä vatsakalvon onteloon aikaan kirurgisen resektion, institutionaalinen käytäntö retroperitoneaalisen sarkooman hallintaan liittyy neoadjuvantti sädehoito, jota seuraa radikaali resektio ja kemoterapia, jos katsotaan tarpeelliseksi tarkistamisen ja lopullisen selittävän patologian keskustelemisen jälkeen. Erityisesti potilaamme otettiin mukaan National Cancer Institute (NCI) sponsoroituun tutkimukseen (DFCI/HCC 12-100), jossa heitä hoidettiin 63 Grayllä (Gy) retroperitoneaaliseen marginaaliin ja 50: llä.4 Gy koko kasvaimen alueella käyttäen lyijykynä palkki skannaus protonit viiden viikon aikana. Potilas sieti tätä hyvin, hänelle tehtiin vakaa uudelleenasennus, ja sen jälkeen hänen retroperitoneaalisesta sarkoomastaan tehtiin radikaali resektio, johon liittyi oikean munuaisen, oikean lisämunuaisen, alaonttolaskimon ja osan vasemmasta munuaislaskimosta resektio jäljempänä kuvatulla tavalla (ks.Toimenpideohje).
Keskustelu
ensimmäinen kuvaus primaarisesta laskimonsisäisestä LMS: stä oli Perl vuonna 1871,7 ja sitä seurasi Melchiorin ensimmäinen resektio vuonna 1928, jossa potilas kuoli 2 viikkoa leikkauksen jälkeen.8 advancements mahdollistaa preoperative suunnittelu, hienosäätö kirurgiset tekniikka ja altistuminen, ja parannuksia kriittisen hoidon, 30 päivän perioperatiivinen kuolleisuus jälkeen resektio IVC LMS on nyt 1,9%.2 kuitenkin 30 päivän sairastuvuus on edelleen huomattava (24,7%).2 kuitenkin kirurginen resektio on edelleen ensisijainen hoitostrategia. Tällä lähestymistavalla pitkän aikavälin 5 vuoden HUONONEMISKERTOIMEN on todettu olevan alhainen (6%), kun taas 5 vuoden kokonaiselossaoloaika on ollut suotuisa (55%).2
viime aikoihin asti useita IVC LMS: ää tutkivan kirjallisuuden raportteja rajoittivat pienet otoskoot. Wachtel et al. on mahdollistanut kattavimman tutkimuksen, johon osallistui 377 potilasta.2 Kun mukautettu analyysi, tekijät, jotka johtavat vähentynyt kokonaiselinaika mukana suuri kasvaimen koko (≥9 cm), vanhempi ikä (≥55 vuotta), tarve omana resektiona, positiivinen marginaali tila, adjuvantti kemoterapiaa, ja kasvaimen sijainti. Erityisesti ensisijainen IVC leiomyosarkoomat luokitellaan laajuuden mukaan laskimoiden osallistuminen ja kuvataan yläraja kasvaimen ja aste kasvaimen laajennus. Käyttämällä tätä luokitusjärjestelmää, segmentti I kasvaimet ovat infrapuna, segmentti II ovat interrenal ja / tai suprarenal jopa, mutta ei sisällä suprahepatic laskimot, ja segmentti III ovat niitä, jotka ulottuvat suprahepatic laskimot ja on mahdollista intrakardiaalinen laajennus. Segmentti II, tai keskellä segmentti, kasvaimet ovat yleisimpiä ja on todettu olevan parempia tuloksia kuin johtuvat joko segmentin I tai segmentin III.2,9 osittain, tämän uskotaan johtuvan varhainen tunnustaminen kasvaimia segmentin II koska lähempänä anatominen läheisyys näiden kasvainten useita elimiä, jotka voivat johtaa kipua tai tukos.2 potilaamme kasvain voidaan parhaiten luokitella segmentin II leesio.
joitakin IVC LMS: n resektion ja jälleenrakentamisen operatiivista menettelyä koskevia huomautuksia on syytä käsitellä lisää. Mitä altistuminen, vatsan lähestymistapa (mediaani laparotomy tai oikea subcostal viillon) on käytetty useimmissa tapauksissa (60%) taas thoracoabdominal lähestymistapa mahdollista sternotomy voidaan käyttää riippuen eri anatomia kasvain on resected.3 erityisesti kasvaimia ulottuu retrohepatic tai suprahepatic vena cava, yhteensä maksan syrjäytymisen avulla kiristys IVC ylä-ja alapuolella maksan lisäksi puristus porttilaskimo voi olla tarpeen. Potilailla, joilla on sydämen sisäinen laajennus, riittävä altistus kardiopulmonaarisen ohitusleikkauksen mahdollistamiseksi voi olla tarpeen. Yleensä potilaat, joilla on infrahepaattiseen ja parareenaaliseen cavaan eristettyjä kasvaimia, sietävät todennäköisesti IVC: n täydellistä ristikiinnitystä ilman merkittäviä hemodynaamisia muutoksia, kunhan riittävä esijännitys varmistetaan asianmukaisella inoperatiivisella elvytyksellä anestesiaryhmällä. Tekniikan osalta potilailla, joilla on laskimopaine (proksimaalinen laskimopaine 30 mmHg tai suurempi), suositellaan rekonstruktiota (toisin kuin ligaatio, primaarinen resektio tai cavoplasty) leikkauksen jälkeisen alaraajaturvotuksen estämiseksi.3 Lisäksi, reimplantation munuaisten tai maksan laskimot voivat olla tarpeen riippuen laajuudesta kasvain resected. Tällä hetkellä ei ole olemassa standardia postoperatiiviselle antikoagulanttihoidolle, ja antitromboottinen aspiriinihoito, jota käytettiin potilaallamme, joka kotiutettiin 325 mg: lla aspiriinia päivittäin, liittyy alhaisiin postoperatiivisiin siirteen trombooseihin.10
satunnaistettuja kontrolloituja tutkimuksia, joissa arvioidaan kemoterapian tai sädehoidon tehoa laskimonsisäisen laskimotromboosin hoidossa, ei ehkä koskaan julkaista sairauden harvinaisuuden vuoksi. Potilaamme lopullinen patologia oli merkittävä luokan 2/3 leiomyosarkooma (yPT2bN0) negatiivisilla marginaaleilla. Keskusteltuamme syöpälääkärin kanssa päätimme, että hän ei tarvinnut ylimääräistä adjuvanttihoitoa. Seurantatutkimusten yhteydessä tulee käyttää TT-kuvausten aikaväliä, jotta voidaan arvioida paikallinen uusiutuminen ja etäpesäke uusiutumisriskin perusteella.6 saimme ensimmäisen valvontakuvauksen 3 kuukauden iässä, ja se oli normaalia. Tapauksissa kaukainen toistuminen, kirurginen resektio suositellaan samoin kuin systeemisen hoidon käyttö niille, jotka eivät voi sietää leikkausta.4
IVC LMS-potilailla elinajan pidentäminen on mahdollista ja vaatii monitieteistä lähestymistapaa. Vaikka leikkaus on edelleen hoidon kulmakivi, osallistuminen lääketieteellisen ja säteilyn onkologian sekä useita kirurgisia osa-alueita (esim.kirurginen onkologia ja elinsiirtoleikkaus) kannustetaan optimaalisesti hallita ja yksilöllistää hoitoa potilaille, joilla on tämä harvinainen maligniteetti.
tiedot
tekijöillä ei ole olennaisia tietoja.
Suostumusilmoitus
tässä videoartikkelissa mainittu potilas on antanut tietoisen suostumuksensa kuvaamiseen ja on tietoinen siitä, että tietoja ja kuvia julkaistaan verkossa.
lainaukset
- Hollenbeck ST, Grobmyer SR, Kent KC, Brennan MF. Kirurginen hoito ja tulokset potilailla, joilla on primaarinen huonompi Alaonttolaskimo leiomyosarkooma. J Am Coll Surg. 2003; 197 (4): 575-579. doi: 10.1016 / S1072-7515(03)00433-2.
- Wachtel H, Gupta M, Bartlett EK, et al. Tulokset jälkeen resektio leiomyosarcomas huonompi vena cava: yhdistetty data analyysi 377 tapausta. Surg Oncol. 2015;24(1):21-27. doi: 10.1016 / J. suronc.2014.10.007.
- Kieffer E, Alaoui M, Piette JC, Cacoub P, Chiche L. leiomyosarkooma alaonttolaskimossa: kokemus 22 tapauksessa. Ann Surg. 2006; 244 (2): 289-295. doi: 10.1097 / 01.sla.0000229964.71743.db.
- Cananzi FCM, Mussi C, Bordoni MG, et al. Leikkauksen rooli alemman alaonttolaskimon primaarisen ja uusiutuvan leiomyosarkooman multimodaalisessa hoidossa. J Surg Onkol. 2016;114(1):44-49. doi: 10.1002 / jso.24244.
- Ganeshalingam s, Rajeswaran G, Jones RL, Thway K, Moskovic E. leiomyosarcomas of the inferior vena cava: diagnostic features on cross-sectional imaging. Clin Radiol. 2011;66(1):50-56. doi: 10.1016 / j. crad.2010.08.004.
- Dull BZ, Smith B, Tefera G, Weber S. Kirurginen hoito retroperitoneaalinen leiomyosarkooma johtuvat huonompi vena cava. J Maha-Suolikanavan Leikkaus 2013;17(12): 2166-2171. doi: 10.1007 / s11605-013-2385-0.
- Perl L, Virchow R. alaonttolaskimon sarkooma. Archiv für pathologische Anatomie und Physiologie und für klinische Medicin. 1871;53(4):378-383. doi: 10.1007 / BF01957198.
- Melchior E. alaonttolaskimon sarkooma. German Journal of Surgery. 1928;213(1-2):135-140. doi: 10.1007 / BF02796714.
- Mingoli a, Cavallaro A, Sapienza P, Di Marzo L, Feldhaus RJ, Cavallari N. International registry of inferior vena cava leiomyosarcoma: analysis of a world series on 218 patients. Anticancer Res. 1996;16(5B):3201-3205.
- Fiore M, Colombo C, Locati P, et al. Kirurginen tekniikka, sairastuvuus ja primäärisen retroperitoneaalisen sarkooman tulos, johon liittyy Alaonttolaskimo. Ann Surg Oncol. 2012;19(2):511-518. doi: 10.1245 / s10434-011-1954-2.