absztrakt
az inferior vena cava (IVC) primer Leiomyosarcomái ritka daganatok, komplex anatómiai kapcsolatokkal. A műtéti reszekció továbbra is a kezelés elsődleges megközelítése, a preoperatív sugárzás szelektív alkalmazásával kemoterápia. Tekintettel ezeknek a daganatoknak a helyi inváziójára, gyakran szükség van a környező struktúrák radikális reszekciójára. Itt leírjuk ezeknek az elváltozásoknak a bemutatását, feldolgozását, operatív kezelését és kimenetelét az IVC középső szegmensét érintő daganatos beteg esetén keresztül. Tekintettel az érintettség mértékére, IVC reszekció en bloc jobb nephrectomiával, jobb adrenalectomia, részleges bal vese véna reszekcióval végeztük vaszkuláris rekonstrukcióval protézis graft alkalmazásával. Megfelelő preoperatív tervezéssel és jól koordinált multidiszciplináris megközelítéssel az agresszív műtéti reszekció biztonságosan elvégezhető, és a betegek számára előnyös lehet a kedvező hosszú távú túlélés.
eset áttekintése
háttér
az inferior vena cava (IVC) leiomyosarcoma (LMS) az összes lágyrész-szarkóma kevesebb mint 0,5% – át képviseli, a véna simaizomát érintő nem gyakori neoplazma.1 a betegség gyakrabban fordul elő nőknél (3:1) Az élet ötödik évtizedében.2 megfigyelték, hogy a tumor maximális átmérője 8-37 centiméter között mozog.3 A jobb vese vagy mellékvese érintettségén kívül a jobb vagy a bal máj, az infrarenalis aorta, az intrakardiális régió és a supradiaphragmaticus jobb tüdő közvetlen kiterjedését figyelték meg.3 az esetek többségében a betegek preoperatív szövettani diagnózist kapnak akár perkután biopsziával, akár laparotómiával.3
a beteg fókuszált története
egy 73 éves nő, akinek anamnézisében időszakos alsó hátfájás, alsó végtag duzzanat és hat font fogyás volt egy év alatt. Korábbi kórtörténete figyelemre méltó volt a magas vérnyomás miatt, amelyre atenololt, hidroklorotiazidot és Nifedipint, valamint refluxot szedett, amelyre omeprazolt kapott. Az elsődleges orvos által végzett munka után számítógépes tomográfiás (CT) vizsgálatot kapott a hasról és a medencéről, amely a biopsziás és a leiomyosarcoma konzisztensnek bizonyult a juxtarenalis IVC mentén. 1).
fizikális vizsgálat
az IVC LMS-ben szenvedő betegek leggyakoribb tünete a hasi fájdalom (59,9%), amelyet alsó végtagi ödéma (14,8%), fogyás (11,4%), hátfájás (9,7%) és hasi puffadás (9,3%) követ.Úgy gondolják, hogy az 1-4 alsó végtagi ödéma csak a betegek töredékében fordul elő, valószínűleg a vénás biztosítékok kialakulása miatt lassú tumor növekedés. Sokkal ritkábban a mélyvénás trombózis (1,7%) vagy a Budd-Chiari szindróma (1,3%) felelős a megjelenésért.1-4 további tünet, például szívritmuszavar lehet jelen azoknál a betegeknél, akiknek intrakardiális daganata a jobb pitvarba nyúlik. Mint említettük, a betegünknél időszakos derékfájás, alsó végtag duzzanat és fogyás volt. A fizikális vizsgálat során azonban jól látszott, puha, nem érzékeny hasa volt, hepatosplenomegalia nélkül, és megfigyelték, hogy nem ödémás disztális végtagjai vannak. A vizsgája egyébként figyelemre méltó volt.
képalkotás
axiális képalkotás CT vagy mágneses rezonancia képalkotás (MRI) alkalmazásával az LMS-ben szenvedő betegek értékelésének elsődleges képalkotási módja, mivel ezek a vizsgálatok részleteket nyújtanak a daganat mértékéről, helyi invázió, távoli betegség. A CT-n az IVC LMS heterogén, nem kalcifikált tömegként jelenik meg perifériás javítással.5 az MRI képek figyelemre méltóak a T1 súlyozott képek alacsony jelintenzitása, a T2 súlyozott képek magas jelintenzitása miatt.5 a betegek egy része hasi ultrahangot is kaphat, ahol a valós idejű Doppler meghatározhatja az érelzáródás és a trombózis mértékét. Bár egyes szerzők olyan invazív vizsgálatokat javasoltak,mint a növekvő vagy retrográd cavográfia és a szelektív arteriográfia, 3 ezek egyre ritkábbak, tekintettel a nem invazív axiális képalkotással elérhető megnövekedett felbontásra és rekonstrukciókra. A CT képek tovább javíthatók késleltetett fázisú vagy vénás fázisú képekkel, amelyek jobban meg tudják határozni az IVC-t és a maradékáram lumenét. Végül azoknál a betegeknél, akiknél aggodalomra ad okot a tumor intrakardiális kiterjesztése, a transzesophagealis echokardiográfiát műtét előtt meg kell szerezni.
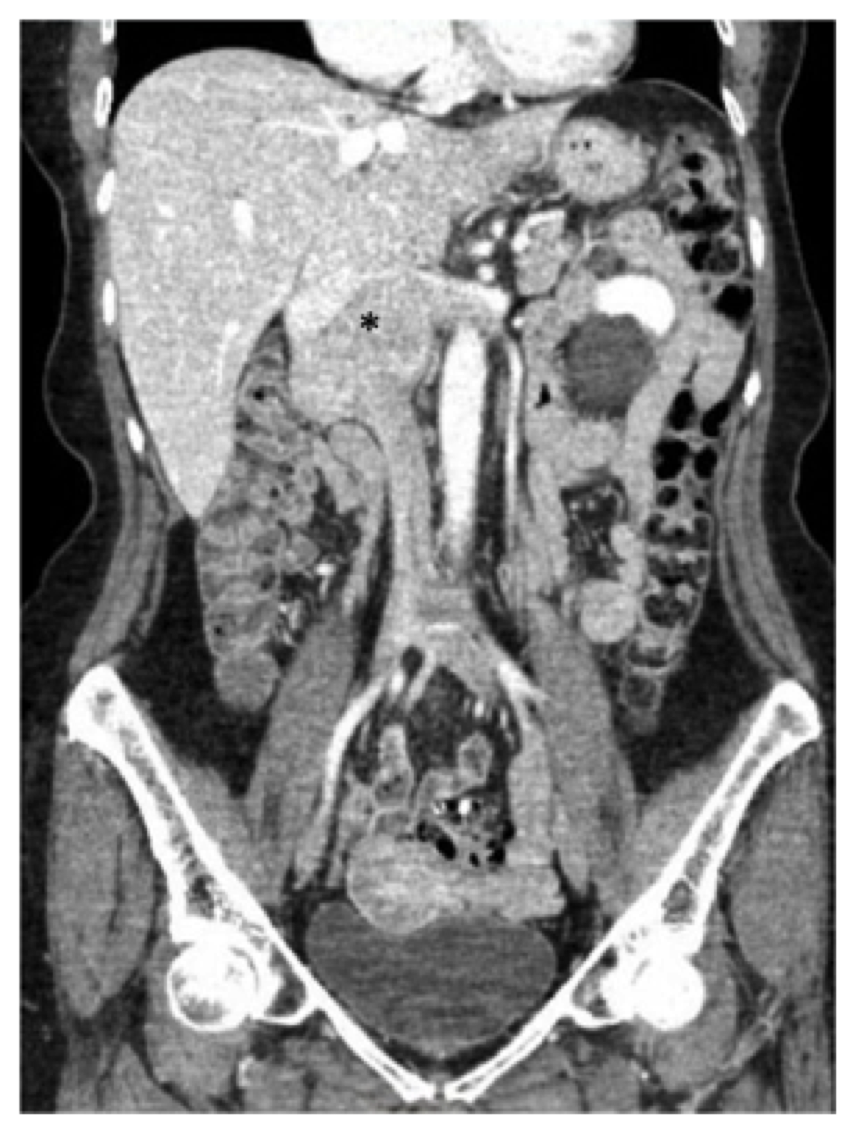 ábra. 1, A has és a medence preoperatív számítógépes tomográfiás (CT) vizsgálata, amely bemutatja az ismert leiomyosarcomát az infrarenalis inferior vena cava (csillag) középpontjában, amely a máj összefolyásának szintjéig és oldalirányban a vese vénákba terjed.
ábra. 1, A has és a medence preoperatív számítógépes tomográfiás (CT) vizsgálata, amely bemutatja az ismert leiomyosarcomát az infrarenalis inferior vena cava (csillag) középpontjában, amely a máj összefolyásának szintjéig és oldalirányban a vese vénákba terjed. a beteg ebben a jelentésben CT – vizsgálaton esett át a has és a medence kontrasztjával, és megfigyeltünk egy 7,5 cm – es tömeget, amely magában foglalja az IVC-t, amely a vese vénák szintjén kezdődik (a jobb vese vénája nagymértékben részt vett, és a bal vese vénájának eredete is érintett volt) a májvénák szintjére-de nem vett részt (ábra. 1). Megfigyelték, hogy a duodenum és a hasnyálmirigy elülső irányban eltolódott, közvetlen invázió nélkül.
Natural History
az elsődleges IVC LMS-t egységesen végzetesnek és 3 éves túlélés nélkül találták azoknál a betegeknél, akik hiányos reszekciót kaptak.1 az összesített analízis alapján a műtéti resectión átesett betegeknél az 1 – és 5 éves betegségmentes túlélés (disease free survival, DFS) alacsonynak bizonyult (sorrendben 57%, illetve 6%). A teljes túlélés azonban kedvező volt (92%, illetve 55%).2
kezelési lehetőségek
a teljes műtéti reszekció az előnyben részesített kezelés azoknál a betegeknél, akik tolerálják a műtétet, és gyakran szükségessé teszik az érintett szomszédos szervek teljes reszekcióját. Az IVC lekötésével végzett reszekció elvégezhető infrarenális daganatok vagy azok esetében, amelyek szükségessé teszik a jobb vese reszekcióját, amelyben a bal vese jelentős fedezetei alakultak ki. A betegek körülbelül egynegyedében részleges IVC reszekció végezhető.3 javasolták, hogy ha a kerület 75% – át eltávolítják, teljes reszekcióra és rekonstrukcióra van szükség.6 azok számára, akik rekonstrukciót igényelnek, egy gyűrűs politetrafluor-etilén (PTFE) protézis méretezhető, hogy megfeleljen, és 4-0 vagy 5-0 Polipropilén varrattal varrható a helyére. A kemoterápia vagy a sugárterápia alkalmazása neoadjuváns vagy adjuváns terápiaként egyre nagyobb szerepet játszhat. Figyelembe véve azonban ennek a betegségnek a ritkaságát és a kevés a kezelés kimenetele a mai napig rendelkezésre álló adatok, ezeket a módozatokat jelenleg minden egyes betegre szabják multidiszciplináris megbeszélés után, és alkalmazásuk változékony.
a kezelés indoklása
az elsődleges IVC LMS ritkasága miatt korlátozott tanulmányok támogatják a nem operatív megközelítést, a teljes műtéti reszekció továbbra is az optimális kezelési stratégia.2 a retroperitoneális margón való kiújulás kockázatának csökkentésére irányuló erőfeszítések, valamint a peritoneális üreg daganatos vetése a műtéti reszekció idején a retroperitoneális szarkóma kezelésére vonatkozó intézményi gyakorlatunk neoadjuváns sugárterápiát foglal magában, amelyet radikális reszekció követ és kemoterápia, ha szükségesnek tartják a végső explant patológia áttekintése és megvitatása után. Pontosabban, a betegünk beiratkozott egy nemzeti Rák Intézet (NCI) szponzorált vizsgálatába (DFCI/HCC 12-100), amelyben 63 szürke (Gy) – vel kezelték őket retroperitoneális margó 50.4 Gy az egész tumor területére ceruzasugár-letapogató protonok segítségével öt hét alatt. A beteg ezt jól tolerálta, stabil újrarendezési vizsgálatot végzett, majd a retroperitoneális szarkóma radikális reszekciójával folytatta a jobb vese, a jobb mellékvese, az alsó vena cava, valamint a bal vese vénájának egy része az alábbiakban részletezettek szerint (lásd az eljárás vázlatát).
Vita
az elsődleges IVC LMS első leírása 1871-ben volt Perl,7, majd az első reszekció Melchior 1928-ban, amelyben a beteg 2 héttel a műtét után meghalt.8 a preoperatív tervezést, a műtéti technika és az expozíció finomítását, valamint a kritikus ellátás javulását lehetővé tevő fejlesztésekkel az IVC LMS reszekciója után a 30 napos perioperatív mortalitás most 1,9%.2 azonban továbbra is jelentős 30 napos morbiditás (24,7%).2 Ennek ellenére a műtéti reszekció továbbra is az elsődleges kezelési stratégia. Ezzel a megközelítéssel a hosszú távú 5 éves DFS-t alacsonynak (6%), míg az 5 éves teljes túlélés kedvező volt (55%).2
a közelmúltig az IVC LMS-t tanulmányozó szakirodalomban számos jelentést korlátoztak kis mintaméretek. A Wachtel et al. lehetővé tette a legátfogóbb vizsgálatot, amely 377 beteget tartalmazott.2 a korrigált elemzés alapján a teljes túlélés csökkenéséhez vezető tényezők közé tartozott a nagy tumorméret (9 cm), az idősebb életkor (55 év), az en bloc resectio szükségessége, a pozitív margó státusz, az adjuváns kemoterápia és a tumor elhelyezkedése. Pontosabban, az elsődleges IVC leiomyosarcomákat a vénás érintettség mértéke szerint osztályozzák, és a tumor felső határa és a tumor kiterjedésének mértéke írja le. Ennek az osztályozási rendszernek az alkalmazásával az I. szegmens tumorai infrarenálisak, a II.szegmens interrenális és/vagy suprarenalis a szuprahepatikus vénákig, de nem számítva, és a III. szegmens azok, amelyek a szuprahepatikus vénákba nyúlnak, és lehetséges intrakardiális kiterjesztéssel rendelkeznek. Szegmens, vagy középső szegmens, a daganatok a leggyakoribbak, és azt találták, hogy jobb eredményeik vannak, mint bármelyikben felmerülők szegmens i vagy szegmens III.2,9 részben úgy gondolják, hogy ennek oka a daganatok korai felismerése a szegmensben II ezeknek a daganatoknak a szorosabb anatómiai közelsége miatt több szervhez, ami fájdalomhoz vagy elzáródáshoz vezethet.2 betegünk daganatát legjobban szegmens II elváltozásnak lehet besorolni.
néhány megjegyzés az IVC LMS reszekció és rekonstrukció operatív eljárásával kapcsolatban további vitát igényel. Az expozíciót illetően hasi megközelítést (medián laparotómiát vagy jobb subcostalis bemetszést) alkalmaztak az esetek többségében (60%), míg a Thoracoabdominalis megközelítés lehetséges sternotomiával alkalmazható a reszektált daganat különálló anatómiájától függően.3 pontosabban a retrohepatikus vagy szuprahepatikus vena cava-ba kiterjedő daganatok esetén a máj teljes kizárása az IVC befogásával a máj felett és alatt a portális véna befogása mellett szükség lehet. Intrakardiális kiterjesztésű betegeknél a cardiopulmonalis bypass-t lehetővé tevő megfelelő expozíció indokolt lehet. Általában az infrahepatikus és pararenalis cava-hoz izolált daganatos betegek valószínűleg tolerálják az IVC teljes keresztzárását jelentős hemodinamikai változások nélkül, mindaddig, amíg a megfelelő előterhelést megfelelő intraoperatív újraélesztéssel biztosítják az érzéstelenítő csapat. Ami a technikát illeti, vénás hipertóniában szenvedő betegeknél (proximális vénás nyomás 30 Hgmm vagy annál nagyobb), rekonstrukció (szemben a ligálással, elsődleges reszekcióval vagy cavoplasztikával) ajánlott a műtét utáni alsó végtagi ödéma megelőzésére.3 ezenkívül a vese-vagy májvénák újbóli beültetése szükséges lehet a tumor reszekciójának mértékétől függően. Jelenleg nincs szabvány a posztoperatív antikoaguláció kezelésére, valamint a vérlemezke-gátló aszpirin terápiára, amint azt a betegünknél alkalmazták, akit napi 325 mg aszpirinnel bocsátottak ki, a posztoperatív graft alacsony arányával jár trombózis.10
randomizált, kontrollos vizsgálatok a kemoterápia vagy a sugárterápia hatékonyságát az IVC LMS kezelésében a betegség ritkasága miatt soha nem lehet közzétenni. Betegünk végső patológiája figyelemre méltó volt a 2/3-as fokozatú leiomyosarcoma (yPT2bN0) negatív margókkal. Az orvosi onkológiával folytatott megbeszélés után úgy döntöttünk, hogy nem igényel további adjuváns terápiát. A nyomon követést illetően a lokális kiújulás és a távoli metasztázisok kiújulásának kockázata alapján intervallumos CT-vizsgálatokat kell alkalmazni.6 az első megfigyelési vizsgálatot 3 hónapon belül kaptuk meg, és ez normális volt. Távoli kiújulás esetén műtéti reszekció ajánlott, csakúgy, mint szisztémás terápia alkalmazása azok számára, akik nem tolerálják a műtétet.4
az IVC LMS-ben szenvedő betegek elhúzódó túlélése lehetséges, és multidiszciplináris megközelítést igényel. Bár a műtét továbbra is a kezelés sarokköve, az orvosi és sugárterápiás onkológia, valamint a több műtéti alspecialitás (pl. sebészeti onkológia és transzplantációs sebészet) bevonása arra ösztönzik, hogy optimálisan kezeljék és individualizálják a ritka rosszindulatú daganatos betegek kezelését.
közzétételek
a szerzőknek nincsenek releváns közzétételeik.
beleegyezési nyilatkozat
az ebben a videócikkben említett beteg tájékozott beleegyezését adta a filmkészítéshez, és tisztában van azzal, hogy az információkat és a képeket online közzéteszik.
Idézetek
- Hollenbeck ST, GROBMYER SR, Kent KC, Brennan MF. Primer inferior vena cava leiomyosarcomában szenvedő betegek sebészeti kezelése és eredményei. J Am Coll Surg. 2003;197(4): 575-579. doi:10.1016 / S1072-7515 (03) 00433-2.
- Wachtel H, Gupta M, Bartlett EK, et al. Eredmények az alsó vena cava leiomyosarcomáinak reszekciója után: 377 eset összesített adatelemzése. Surg Onkol. 2015;24(1):21-27. doi: 10.1016 / j.suronc.2014.10.007.
- Kieffer E, Alaoui M, Piette JC, Cacoub P, Chiche L. az alsó vena cava Leiomyosarcoma: tapasztalat 22 esetben. Ann Surg. 2006;244(2): 289-295. doi:10.1097 / 01.sla.0000229964.71743.db.
- Cananzi FCM, Mussi C, Bordoni MG és mtsai. A műtét szerepe az inferior vena cava primer és visszatérő leiomyosarcoma multimodális kezelésében. J Surg Oncol. 2016;114(1):44-49. doi: 10.1002 / jso.24244.
- Ganeshalingam S, Rajeswaran G, Jones RL, Thway K, Moskovic E. az alsó vena cava leiomyosarcomái: a keresztmetszeti képalkotás diagnosztikai jellemzői. Clin Radiol. 2011;66(1):50-56. doi: 10.1016 / j. crad.2010.08.004.
- Dull BZ, Smith B, Tefera G, Weber S. Az alsó vena cava-ból származó retroperitoneális leiomyosarcoma műtéti kezelése. J Gasztrointesztinális Műtét 2013;17 (12): 2166-2171. doi: 10.1007 / s11605-013-2385-0.
- Perl L, Virchow R. az alsó vena cava szarkóma esete. Archives of unconnectiv pathologische Anatomie und Physiologie und F unconnectiv klinische Medicine. 1871;53(4):378-383. doi:10.1007 / BF01957198.
- Melchior E. az alsó vena cava szarkóma. Német sebészeti folyóirat. 1928;213(1-2):135-140. doi:10.1007 / BF02796714.
- Mingoli A, Cavallaro A, Sapienza P, Di Marzo L, Feldhaus RJ, Cavallari N. Az inferior vena cava leiomyosarcoma nemzetközi nyilvántartása: 218 beteg világsorozatának elemzése. Rákellenes res. 1996;16(5B): 3201-3205.
- Fiore M, Colombo C, Locati P, et al. Sebészeti technika, morbiditás és primer retroperitonealis sarcoma kimenetele inferior vena cava bevonásával. Ann Surg Oncol. 2012;19(2):511-518. doi: 10.1245 / s10434-011-1954-2.