resumo
leiomiossarcomas primários da veia cava inferior (CIV) são tumores raros com relações anatômicas complexas. A ressecção cirúrgica continua sendo a principal abordagem para o manejo, com uso seletivo de radiação pré-operatória e quimioterapia. Dada a propensão para a invasão local desses tumores, a ressecção radical das estruturas circundantes é frequentemente necessária. Aqui, descrevemos a apresentação, o trabalho, o manejo operatório e os resultados dessas lesões por meio do caso de um paciente com tumor envolvendo o segmento médio da CIV. Dada a extensão do envolvimento, a ressecção por IVC com nefrectomia direita em bloco, adrenalectomia direita e ressecção parcial da veia renal esquerda foi realizada com reconstrução vascular usando um enxerto protético. Com planejamento pré-operatório adequado e uma abordagem multidisciplinar bem coordenada, a ressecção cirúrgica agressiva pode ser realizada com segurança e os pacientes podem se beneficiar de uma sobrevida favorável a longo prazo.
Visão geral do Caso
Fundo
Representa menos de 0,5% de todos os sarcomas de tecidos moles, leiomiossarcoma (LMS) da veia cava inferior (VCI) é uma neoplasia incomum que envolvem o músculo liso da veia.1 a doença é mais comumente vista em mulheres (3:1) na quinta década de vida.2 diâmetro máximo do tumor foi observado para variar entre 8-37 centímetros.3 além do envolvimento do rim direito ou adrenal, observou-se extensão direta para o fígado direito ou esquerdo, aorta infra-renal, região intracardíaca e pulmão supradiafragmático direito.3 na maioria dos casos, os pacientes recebem um diagnóstico histológico pré-operatório por biópsia percutânea ou laparotomia.3
história focada do paciente
uma mulher de 73 anos apresentou história de dor lombar intermitente, inchaço das extremidades inferiores e perda de peso de seis libras ao longo de um ano. Seu histórico médico anterior foi notável pela hipertensão para a qual ela tomou atenolol, hidroclorotiazida e nifedipina, bem como refluxo para o qual ela foi mantida em omeprazol. Após o trabalho de seu médico de atenção primária, ela recebeu uma tomografia computadorizada (TC) do abdômen e da pelve demonstrando uma massa ao longo da CIV justarenal que foi biopsiada e considerada consistente com o leiomiossarcoma (Fig. 1).
exame físico
o sintoma de apresentação mais comum para pacientes com CMIV é a dor abdominal (59,9%), seguida de edema das extremidades inferiores (14,8%), perda de peso (11,4%), dor nas costas (9,7%) e distensão abdominal (9,3%).Acredita-se que o edema das extremidades inferiores ocorra apenas em uma fração dos pacientes provavelmente devido ao desenvolvimento de colaterais venosos no cenário de crescimento lento do tumor. Muito menos frequentemente, trombose venosa profunda (1,7%) ou síndrome de Budd-Chiari (1,3%) são responsáveis pela apresentação.1-4 sinais adicionais, como arritmia cardíaca, podem estar presentes em pacientes com extensão do tumor intracardíaco no átrio direito. Como mencionado, nosso paciente apresentou história de dor lombar intermitente, inchaço das extremidades inferiores e perda de peso. No exame físico, no entanto, ela estava bem aparecendo, tinha um abdômen macio e não sensível sem hepatoesplenomegalia e observou-se que tinha extremidades distais não edematosas. Seu exame era normal.
imagens
imagens axiais usando TC ou ressonância magnética (MRI) constituem a modalidade de imagem primária para avaliar pacientes que se apresentam com LMS, pois essas varreduras fornecem detalhes sobre a extensão do tumor, invasão local e doença distante. Na TC, o LMS da IVC aparece como uma massa heterogênea e não calcificada com realce periférico.5 imagens de ressonância magnética são notáveis pela baixa intensidade do sinal em imagens ponderadas em T1 e alta intensidade do sinal em imagens ponderadas em T2.5 uma porção de pacientes também pode receber ultrassonografia abdominal, onde o Doppler em tempo real pode delinear o grau de obstrução vascular e trombose. Embora estudos invasivos como cavografia ascendente ou retrógrada e arteriografia seletiva tenham sido defendidos por alguns autores,3 eles estão se tornando menos comuns devido ao aumento da resolução e reconstruções que podem ser obtidas por meio de imagens axiais não invasivas. As imagens de TC podem ser ainda melhoradas por imagens de fase retardada ou de fase venosa que podem delinear melhor a CIV e o lúmen do fluxo residual. Por fim, em pacientes em que há preocupação com a extensão intracardíaca do tumor, a ecocardiografia transesofágica deve ser obtida no pré-operatório.
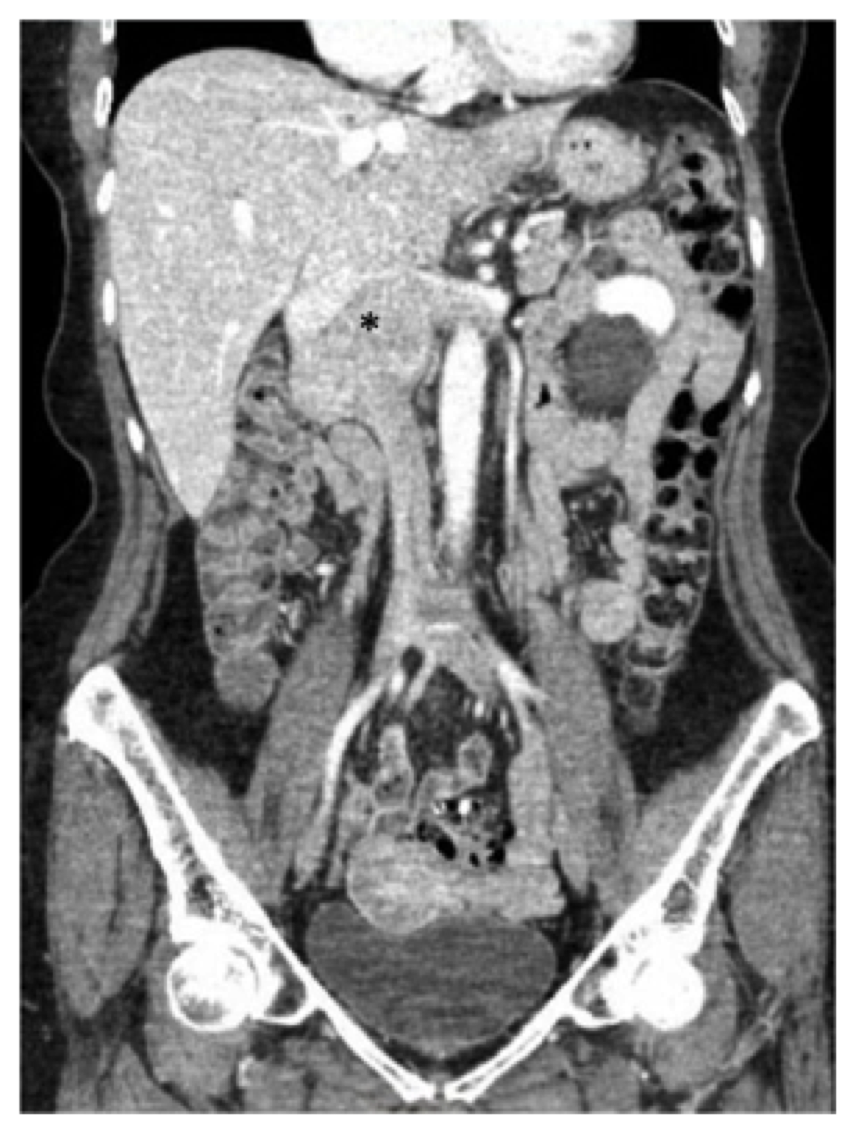 Fig. 1, tomografia computadorizada pré-operatória (TC) do abdome e pelve demonstrando o leiomiossarcoma conhecido centrado na veia cava inferior infrarrenal (asterisco), estendendo-se superiormente ao nível da confluência hepática e lateralmente nas veias renais.
Fig. 1, tomografia computadorizada pré-operatória (TC) do abdome e pelve demonstrando o leiomiossarcoma conhecido centrado na veia cava inferior infrarrenal (asterisco), estendendo-se superiormente ao nível da confluência hepática e lateralmente nas veias renais. O paciente neste relatório foram submetidos a uma tomografia computadorizada com contraste de abdome e pelve, e observamos a 7,5 cm de massa envolvendo o IVC começo ao nível das veias renais (a veia renal direita foi amplamente envolvido e houve também o envolvimento da origem da veia renal esquerda), ao nível de, mas não envolvendo – as veias hepáticas (Fig. 1). Observou-se que o duodeno e o pâncreas foram deslocados anteriormente sem evidência de invasão direta.
História Natural
a VCI primária LMS foi considerada uniformemente fatal e sem sobrevida em 3 anos em pacientes que receberam ressecção incompleta.1 na análise combinada, em pacientes submetidos à ressecção cirúrgica, observou – se que a sobrevida livre de doença (DFS) de 1 e 5 anos é baixa (57% e 6%, respectivamente). No entanto, a sobrevida global tem sido favorável (92% e 55%, respectivamente).2
opções de tratamento
a ressecção cirúrgica completa é o tratamento preferido para pacientes que podem tolerar a cirurgia e muitas vezes necessitam de ressecção em bloco de órgãos adjacentes envolvidos. A ressecção com ligadura da CIV pode ser realizada para tumores infra-renais ou aqueles que necessitam de ressecção do rim direito em que colaterais substanciais para o rim esquerdo se formaram. Em aproximadamente um quarto dos pacientes, a ressecção parcial da CIV pode ser realizada.3 foi sugerido que, se 75% da circunferência for removida, é necessária ressecção e reconstrução completas.6 para aqueles que necessitam de reconstrução, uma prótese de politetrafluoroetileno (PTFE) anelada pode ser dimensionada para combinar e pode ser suturada no lugar com uma sutura de polipropileno 4-0 ou 5-0. O uso de quimioterapia ou radioterapia como terapia neoadjuvante ou adjuvante pode ter um papel crescente. No entanto, dada a raridade desta doença e a escassez de dados de resultados de tratamento disponíveis até o momento, essas modalidades são atualmente adaptadas a cada paciente individual após discussão multidisciplinar, e há variabilidade em sua aplicação.
justificativa para o tratamento
dada a raridade da CMIV primária, existem estudos limitados que apoiam uma abordagem não operatória e a ressecção cirúrgica completa continua sendo a estratégia de gerenciamento ideal.2 Em esforços para diminuir o risco de recorrência na retroperitoneal margem bem como tumor de propagação da cavidade peritoneal no momento da ressecção cirúrgica, a nossa prática institucional para a gestão dos sarcomas retroperitoneais envolve radioterapia neoadjuvante seguida por ressecção radical e quimioterapia, se considerado necessário, depois de rever e discutir final de explante de patologia. Especificamente, nosso paciente foi inscrito em um estudo patrocinado pelo National Cancer Institute (NCI) (DFCI/HCC 12-100) no qual foram tratados com 63 Gray (Gy) para a margem retroperitoneal e 50.4 Gy para toda a área do tumor usando prótons de varredura de feixe de lápis ao longo de cinco semanas. A paciente tolerou isso bem, teve um exame de estadiamento estável e, posteriormente, procedeu à ressecção radical de seu sarcoma retroperitoneal com ressecção em bloco do rim direito, da glândula adrenal direita, da veia cava inferior e de uma porção da veia renal esquerda, conforme detalhado abaixo (ver esboço do procedimento).
discussão
a primeira descrição de um LMS primário de IVC foi em 1871 por Perl, 7 seguida da primeira ressecção por Melchior em 1928 em que o paciente morreu 2 semanas no pós-operatório.8 com avanços que permitem o planejamento pré-operatório, o refinamento da técnica cirúrgica e a exposição e melhorias nos cuidados intensivos, a mortalidade perioperatória de 30 dias após a ressecção da IVC LMS é agora de 1,9%.2 no entanto, permanece uma morbidade substancial de 30 dias (24,7%).2 no entanto, a ressecção cirúrgica continua sendo a principal estratégia de tratamento. Com essa abordagem, a DFS de longo prazo de 5 anos foi considerada baixa (6%), enquanto a sobrevida geral de 5 anos foi favorável (55%).2
até recentemente, uma série de relatórios na literatura que estudavam IVC LMS eram limitados por pequenos tamanhos de amostra. Uma análise conjunta de Wachtel et al. permitiu o estudo mais abrangente, incluindo 377 pacientes.2 após a análise ajustada, os fatores identificados como levando à diminuição da sobrevida geral incluíram Tamanho Grande do tumor (≥9 cm), idade mais avançada (≥55 anos), necessidade de ressecção em bloco, status de margem positiva, quimioterapia adjuvante e localização do tumor. Especificamente, os leiomiossarcomas primários de IVC são classificados de acordo com a extensão do envolvimento venoso e são descritos pelo limite superior do tumor e pelo grau de extensão do tumor. Usando este sistema de classificação, o segmento de eu tumores são infrarenal, segmento II são interrenal e/ou suprarenal até, mas não incluindo o suprahepatic veias, e o segmento III são aqueles que se estendem para o suprahepatic veias e eventuais intracardíacos extensão. Segmento II, ou de segmento médio, tumores são mais comuns e foram encontrados para ter resultados melhores do que aqueles decorrentes, em qualquer segmento I ou segmento III.2,9 Em parte, isto é pensado para ser devido à detecção precoce de tumores no Segmento II, devido a um estreitamento anatômico proximidade destes tumores de vários órgãos, o que pode levar à dor ou obstrução.2 o tumor do nosso paciente poderia ser melhor classificado como lesão do segmento II.
alguns comentários sobre o procedimento cirúrgico para ressecção e reconstrução do LMS IVC justificam uma discussão mais aprofundada. Em relação à exposição, uma abordagem abdominal (laparotomia mediana ou incisão subcostal direita) tem sido usada na maioria dos casos (60%), enquanto uma abordagem toracoabdominal com possível esternotomia pode ser empregada dependendo da anatomia distinta do tumor sendo ressecado.3 especificamente, para tumores que se estendem para a veia cava Retro-hepática ou suprahepática, pode ser necessária a exclusão hepática total por meio do pinçamento da CIV acima e abaixo do fígado, além do pinçamento da veia porta. Em pacientes com extensão intracardíaca, pode ser necessária uma exposição adequada para permitir a circulação extracorpórea. Em geral, pacientes com tumores isolados na cava infra-hepática e pararenal provavelmente tolerarão o clampeamento cruzado completo da CIV sem alterações hemodinâmicas significativas, desde que a pré-carga adequada seja assegurada com ressuscitação intraoperatória apropriada pela equipe de anestesia. No que diz respeito à técnica, em pacientes com hipertensão venosa (pressões venosas proximais de 30 mmHg ou mais), recomenda-se a reconstrução (em oposição à ligadura, ressecção primária ou cavoplastia) para prevenir o edema pós-operatório das extremidades inferiores.3 Além disso, pode ser necessário reimplante das veias renal ou hepática, dependendo da extensão do tumor ressecado. Atualmente, não há padrão para o manejo da anticoagulação pós-operatória, e a terapia antiplaquetária com aspirina, como foi usada em nosso paciente que recebeu alta de 325 mg de aspirina por dia, está associada a baixas taxas de trombose do enxerto pós-operatório.10
ensaios clínicos randomizados que avaliam a eficácia da quimioterapia ou radioterapia no tratamento da VCI LMS podem nunca ser publicados devido à raridade da doença. A patologia Final de nosso paciente foi notável por um leiomiossarcoma de grau 2/3 (yPT2bN0) com margens negativas. Após discussão com oncologia médica, decidimos que ela não precisava de nenhuma terapia adjuvante adicional. Em relação ao acompanhamento, as tomografias intervaladas devem ser usadas para avaliar a recorrência local e a metástase à distância com base no risco de recorrência.6 obtivemos nossa primeira varredura de vigilância aos 3 meses, e era normal. Em casos de recorrência à distância, recomenda-se a ressecção cirúrgica, assim como o uso de terapia sistêmica para aqueles incapazes de tolerar uma operação.4
a sobrevida prolongada em pacientes com IVC LMS é possível e requer uma abordagem multidisciplinar. Embora a cirurgia continue sendo a pedra angular do tratamento, o envolvimento da oncologia médica e de radiação, bem como múltiplas subespecialidades cirúrgicas (por exemplo, oncologia cirúrgica e cirurgia de transplante) é encorajado a gerenciar e individualizar de maneira ideal o tratamento para pacientes com essa malignidade rara.
divulgações
os autores não têm divulgações relevantes.
Declaração de consentimento
o paciente referido neste artigo em vídeo deu seu consentimento informado para ser filmado e está ciente de que informações e imagens serão publicadas online.
Citações
- Hollenbeck ST, Grobmyer SR, Kent KC, Brennan MF. Tratamento cirúrgico e desfechos de pacientes com leiomiossarcoma de veia cava inferior primária. J Am Coll Surg. 2003; 197(4): 575-579. doi: 10.1016 / S1072-7515 (03)00433-2.
- Wachtel H, Gupta M, Bartlett Ek, et al. Desfechos após ressecção de leiomiossarcomas da veia cava inferior: uma análise de dados conjunta de 377 casos. Surg Oncol. 2015;24(1):21-27. doi:10.1016 / j. suronc.2014.10.007.
- Kieffer e, Alaoui M, Piette JC, Cacoub P, Chiche L. Leiomyosarcoma da veia cava inferior: experiência em 22 casos. Ann Surg. 2006;244(2):289-295. doi:10.1097 / 01.instrumento.0000229964.71743.PO.
- Cananzi FCM, Mussi C, Bordoni MG, et al. Papel da cirurgia no tratamento multimodal do leiomiossarcoma primário e recorrente da veia cava inferior. J Surg Oncol. 2016;114(1):44-49. doi:10.1002 / jso.24244.Ganeshalingam s, Rajeswaran G, Jones RL, Thway K, Moskovic E. Leiomyosarcomas da veia cava inferior: características diagnósticas em imagens transversais. Clin Radiol. 2011;66(1):50-56. doi:10.1016 / j. crad.2010.08.004.
- BZ maçante, Smith B, Tefera G, Weber S. Manejo cirúrgico do leiomiossarcoma retroperitoneal decorrente da veia cava inferior. J Gastrintestinal Surgery 2013;17(12):2166-2171. doi: 10.1007 / s11605-013-2385-0.
- Perl l, Virchow R. um caso de sarcoma da veia cava inferior. Archiv für pathologische Anatomie und Physiologie und für Klinische Medicin. 1871;53(4):378-383. doi: 10.1007 / BF01957198.
- Melchior E. Sarcoma da veia cava inferior. Jornal alemão de Cirurgia. 1928;213(1-2):135-140. doi: 10.1007 / BF02796714.
- Mingoli a, Cavallaro a, Sapienza P, Di Marzo L, Feldhaus RJ, Cavallari N. Registro Internacional de leiomiossarcoma de veia cava inferior: análise de uma série mundial em 218 pacientes. Anticancerígeno Res. 1996;16(5B):3201-3205.
- Fiore m, Colombo C, Locati P, et al. Técnica cirúrgica, morbidade e desfecho do sarcoma retroperitoneal primário envolvendo veia cava inferior. Ann Surg Oncol. 2012;19(2):511-518. doi:10.1245/s10434-011-1954-2.