Abstract
I leiomiosarcomi primari della vena cava inferiore (IVC) sono tumori rari con relazioni anatomiche complesse. La resezione chirurgica rimane l’approccio primario per la gestione, con l’uso selettivo di radiazioni preoperatorie e chemioterapia. Data la propensione all’invasione locale di questi tumori, è spesso necessaria la resezione radicale delle strutture circostanti. Qui descriviamo la presentazione, work-up, gestione operativa, e gli esiti di queste lesioni attraverso il caso di un paziente con un tumore che coinvolge il segmento medio della IVC. Data l’entità del coinvolgimento, la resezione IVC con nefrectomia destra in blocco, adrenalectomia destra e resezione parziale della vena renale sinistra è stata eseguita con ricostruzione vascolare utilizzando un innesto protesico. Con un’adeguata pianificazione preoperatoria e un approccio multidisciplinare ben coordinato, la resezione chirurgica aggressiva può essere eseguita in sicurezza e i pazienti possono beneficiare di una sopravvivenza a lungo termine favorevole.
Panoramica dei casi
Contesto
Rappresentando meno dello 0,5% di tutti i sarcomi dei tessuti molli, il leiomiosarcoma (LMS) della vena cava inferiore (IVC) è una neoplasia non comune che coinvolge la muscolatura liscia della vena.1 La malattia è più comunemente osservata nelle femmine (3:1) nella quinta decade di vita.2 Diametro massimo del tumore è stato notato per variare tra 8-37 centimetri.3 Oltre al coinvolgimento del rene destro o del surrene, sono stati notati l’estensione diretta al fegato destro o sinistro, l’aorta infrarenale, la regione intracardiaca e il polmone destro sopradiafragmatico.3 Nella maggior parte dei casi, i pazienti ricevono una diagnosi istologica preoperatoria mediante biopsia percutanea o laparotomia.3
Storia focalizzata del paziente
Una donna di 73 anni ha presentato una storia di dolore lombare intermittente, gonfiore degli arti inferiori e una perdita di peso di sei chili nel corso di un anno. La sua storia medica passata è stata notevole per l’ipertensione per cui ha preso atenololo, idroclorotiazide e nifedipina così come il reflusso per il quale è stata mantenuta su omeprazolo. Su workup dal suo medico di base, ha ricevuto una tomografia computerizzata (CT) scansione dell’addome e del bacino dimostrando una massa lungo la IVC juxtarenal che è stata biopsied e trovato per essere coerente con leiomiosarcoma (Fig. 1).
Esame fisico
Il sintomo di presentazione più comune per i pazienti con LMS IVC è dolore addominale (59,9%), seguito da edema degli arti inferiori (14,8%), perdita di peso (11,4%), mal di schiena (9,7%) e distensione addominale (9,3%).Si pensa che l’edema degli arti inferiori 1-4 si verifichi solo in una frazione dei pazienti probabilmente a causa dello sviluppo di collaterali venosi nell’ambito della crescita lenta del tumore. Molto meno frequentemente, la trombosi venosa profonda (1,7%) o la sindrome di Budd-Chiari (1,3%) sono responsabili della presentazione.1-4 Ulteriori segni come l’aritmia cardiaca possono essere presenti in pazienti con estensione tumorale intracardiaca nell’atrio destro. Come accennato, il nostro paziente ha presentato una storia di dolore lombare intermittente, gonfiore degli arti inferiori e perdita di peso. All’esame fisico, tuttavia, appariva bene, aveva un addome morbido e non tenero senza epatosplenomegalia ed era nota per avere estremità distali non edematose. Il suo esame era altrimenti insignificante.
Imaging
L’imaging assiale con TC o risonanza magnetica (MRI) costituisce la modalità di imaging primaria per valutare i pazienti che presentano LMS in quanto queste scansioni forniscono dettagli sull’estensione del tumore, dell’invasione locale e della malattia a distanza. Su CT, LMS dell’IVC appare come una massa eterogenea, non calcificata con potenziamento periferico.5 Immagini MRI sono notevoli per bassa intensità del segnale su T1 immagini ponderate e ad alta intensità del segnale su T2 immagini ponderate.5 Una parte dei pazienti può anche ricevere ecografia addominale, dove Doppler in tempo reale può delineare il grado di ostruzione vascolare e trombosi. Sebbene studi invasivi come la cavografia ascendente o retrograda e l’arteriografia selettiva siano stati sostenuti da alcuni autori,3 stanno diventando meno comuni data l’aumento della risoluzione e delle ricostruzioni che possono essere ottenute attraverso l’imaging assiale non invasivo. Le immagini CT possono essere ulteriormente migliorate da immagini in fase ritardata o in fase venosa che possono delineare meglio l’IVC e il lume del flusso residuo. Infine, nei pazienti in cui vi è preoccupazione per l’estensione intracardiaca del tumore, l’ecocardiografia transesofagea deve essere ottenuta preoperativamente.
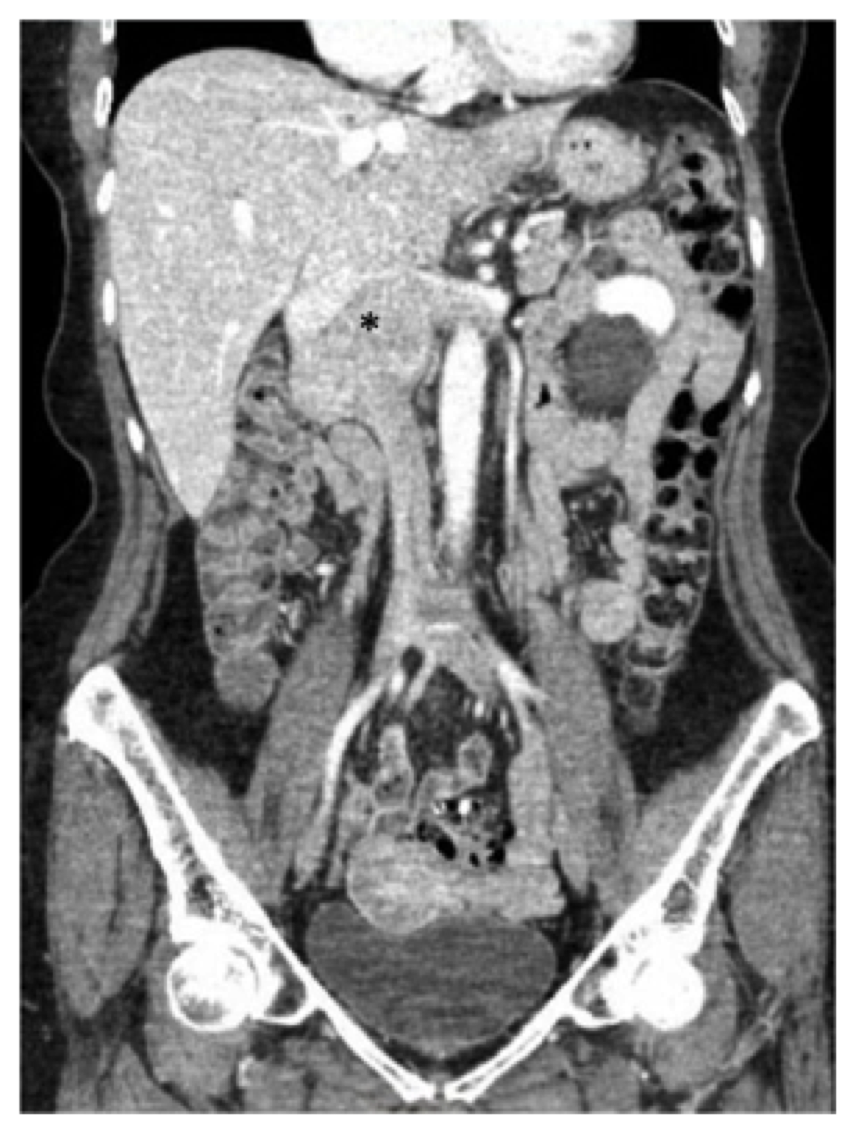 Fig. 1, Tomografia computerizzata preoperatoria (CT) scansione dell’addome e del bacino che dimostra il noto leiomiosarcoma centrato nella vena cava inferiore infrarenale (asterisco), che si estende superiormente al livello della confluenza epatica e lateralmente nelle vene renali.
Fig. 1, Tomografia computerizzata preoperatoria (CT) scansione dell’addome e del bacino che dimostra il noto leiomiosarcoma centrato nella vena cava inferiore infrarenale (asterisco), che si estende superiormente al livello della confluenza epatica e lateralmente nelle vene renali. Il paziente in questa relazione è stato sottoposto ad una TAC con contrasto dell’addome e del bacino, e abbiamo notato una massa di 7,5 cm che coinvolge la IVC a partire dal livello delle vene renali (la vena renale destra era ampiamente coinvolta e c’era anche il coinvolgimento dell’origine della vena renale sinistra) al livello – ma non coinvolgendo – delle vene epatiche (Fig. 1). Il duodeno e il pancreas sono stati notati per essere spostati anteriormente senza prove di invasione diretta.
Storia naturale
La LMS IVC primaria è risultata uniformemente fatale e senza sopravvivenza a 3 anni in pazienti sottoposti a resezione incompleta.1 Su analisi aggregate, nei pazienti sottoposti a resezione chirurgica, la sopravvivenza libera da malattia (DFS) a 1 e 5 anni è stata osservata bassa (57% e 6%, rispettivamente). Tuttavia, la sopravvivenza globale è stata favorevole (92% e 55%, rispettivamente).2
Opzioni per il trattamento
La resezione chirurgica completa è il trattamento preferito per i pazienti che possono tollerare un intervento chirurgico e spesso richiede la resezione in blocco degli organi adiacenti coinvolti. La resezione con legatura dell’IVC può essere eseguita per tumori infrarenali o quelli che richiedono la resezione del rene destro in cui si sono formati sostanziali collaterali per il rene sinistro. In circa un quarto dei pazienti può essere eseguita una resezione IVC parziale.3 È stato suggerito che se il 75% della circonferenza viene rimosso, è necessaria la resezione completa e la ricostruzione.6 Per coloro che richiedono la ricostruzione, una protesi in politetrafluoroetilene (PTFE) anellata può essere dimensionata per adattarsi e può essere suturata in posizione con una sutura in polipropilene 4-0 o 5-0. L’uso della chemioterapia o della radioterapia come terapia neoadiuvante o adiuvante può avere un ruolo crescente. Tuttavia, data la rarità di questa malattia e la scarsità di dati sull’esito del trattamento disponibili fino ad oggi, queste modalità sono attualmente adattate a ciascun singolo paziente dopo una discussione multidisciplinare e vi è variabilità nella loro applicazione.
Motivazione del trattamento
Data la rarità della LMS IVC primaria, esistono studi limitati a supporto di un approccio non operativo e la resezione chirurgica completa rimane la strategia di gestione ottimale.2 gli sforzi per diminuire il rischio di recidiva di malattia a livello retroperitoneale margine così come tumore semina della cavità peritoneale, al momento della resezione chirurgica, la nostra pratica istituzionale per la gestione del sarcoma retroperitoneale comporta radioterapia neoadiuvante seguita da resezione radicale e la chemioterapia, se ritenuto necessario, dopo esame e discussione finale di espianto di patologia. In particolare, il nostro paziente è stato arruolato in uno studio sponsorizzato dal National Cancer Institute (NCI) (DFCI/HCC 12-100) in cui sono stati trattati con 63 Gray (Gy) al margine retroperitoneale e 50.4 Gy per l’intera area del tumore utilizzando protoni di scansione del fascio di matita per cinque settimane. La paziente ha tollerato questo bene, ha avuto una scansione di re-staging stabile e successivamente ha proceduto con la resezione radicale del suo sarcoma retroperitoneale con resezione in blocco del rene destro, della ghiandola surrenale destra, della vena cava inferiore e di una porzione della vena renale sinistra come descritto di seguito (Vedere Schema della procedura).
Discussione
La prima descrizione di un LMS IVC primario fu nel 1871 da Perl,7 seguita dalla prima resezione di Melchior nel 1928 in cui il paziente morì 2 settimane dopo l’intervento.8 Con i progressi che consentono la pianificazione preoperatoria, il perfezionamento della tecnica chirurgica e l’esposizione e il miglioramento delle cure critiche, la mortalità perioperatoria a 30 giorni dopo la resezione di LMS IVC è ora dell ‘ 1,9%.2 Tuttavia, rimane una sostanziale morbilità di 30 giorni (24,7%).2 Tuttavia, la resezione chirurgica rimane la strategia di trattamento primario. Con questo approccio, la DFS a 5 anni a lungo termine è stata notata come bassa (6%) mentre la sopravvivenza globale a 5 anni è stata favorevole (55%).2
Fino a poco tempo fa, un certo numero di rapporti in letteratura che studiavano IVC LMS erano limitati da piccole dimensioni del campione. Un’analisi in pool di Wachtel et al. ha consentito lo studio più completo comprendente 377 pazienti.2 Dopo l’analisi corretta, i fattori identificati come responsabili di una ridotta sopravvivenza globale includevano grandi dimensioni del tumore (≥9 cm), età avanzata (≥55 anni), necessità di resezione in blocco, stato di margine positivo, chemioterapia adiuvante e localizzazione del tumore. In particolare, i leiomiosarcomi IVC primari sono classificati in base all’estensione del coinvolgimento venoso e sono descritti dal limite superiore del tumore e dal grado di estensione del tumore. Usando questo sistema di classificazione, i tumori del segmento I sono infrarenali, il segmento II sono interrenali e / o suprarenali fino a ma non incluse le vene supraepatiche e il segmento III sono quelli che si estendono nelle vene supraepatiche e hanno una possibile estensione intracardiaca. Segmento II, o segmento medio, i tumori sono i più comuni e sono stati trovati per avere risultati migliori rispetto a quelli derivanti in entrambi i segmenti I o segmento III. 2,9 In parte, questo è pensato per essere dovuto al riconoscimento precoce dei tumori nel segmento II a causa di una vicinanza anatomica più stretta di questi tumori a più organi che2 Il tumore del nostro paziente potrebbe essere meglio classificato come lesione di segmento II.
Alcune osservazioni riguardanti la procedura operativa per la resezione e la ricostruzione di LMS IVC meritano ulteriori discussioni. Per quanto riguarda l’esposizione, un approccio addominale (laparotomia mediana o incisione subcostale destra) è stato utilizzato nella maggior parte dei casi (60%), mentre un approccio toracoaddominale con possibile sternotomia può essere impiegato a seconda dell’anatomia distinta del tumore resecato.3 In particolare, per i tumori che si estendono nella vena cava retroepatica o supraepatica, può essere necessaria l’esclusione epatica totale mediante il bloccaggio dell’IVC sopra e sotto il fegato oltre al bloccaggio della vena porta. Nei pazienti con estensione intracardiaca, può essere giustificata un’esposizione adeguata per consentire il bypass cardiopolmonare. In generale, i pazienti con tumori isolati alla cava infraepatica e pararenale tollereranno probabilmente il completo cross-clamping della IVC senza significative alterazioni emodinamiche, purché sia garantito un adeguato precarico con un’appropriata rianimazione intraoperatoria da parte del team di anestesia. Per quanto riguarda la tecnica, nei pazienti con ipertensione venosa (pressioni venose prossimali di 30 mmHg o superiori), la ricostruzione (al contrario di legatura, resezione primaria o cavoplastica) è raccomandata per prevenire l’edema postoperatorio degli arti inferiori.3 Inoltre, il reimpianto delle vene renali o epatiche può essere necessario a seconda dell’entità del tumore resecato. Attualmente non esiste uno standard per la gestione dell’anticoagulazione postoperatoria e la terapia antipiastrinica con aspirina, come è stata utilizzata nel nostro paziente che è stato dimesso con 325 mg di aspirina al giorno, è associata a bassi tassi di trombosi postoperatoria dell’innesto.10
Gli studi randomizzati controllati che valutano l’efficacia della chemioterapia o della radioterapia nella gestione della LMS IVC non possono mai essere pubblicati a causa della rarità della malattia. La patologia finale del nostro paziente è stata notevole per un leiomiosarcoma di grado 2/3 (yPT2bN0) con margini negativi. Dopo aver discusso con l’oncologia medica, abbiamo deciso che non richiedeva alcuna terapia adiuvante aggiuntiva. Per quanto riguarda il follow-up, la TAC a intervalli deve essere utilizzata per valutare la recidiva locale e le metastasi a distanza in base al rischio di recidiva.6 Abbiamo ottenuto la nostra prima scansione di sorveglianza a 3 mesi, ed era normale. Nei casi di recidiva a distanza, si raccomanda la resezione chirurgica così come l’uso della terapia sistemica per coloro che non sono in grado di tollerare un’operazione.4
La sopravvivenza prolungata in pazienti con LMS IVC è possibile e richiede un approccio multidisciplinare. Sebbene la chirurgia rimanga la pietra angolare del trattamento, il coinvolgimento dell’oncologia medica e radiologica e di molteplici sottospecialità chirurgiche (ad esempio, oncologia chirurgica e chirurgia dei trapianti) è incoraggiato a gestire e personalizzare in modo ottimale il trattamento per i pazienti con questa rara malignità.
Informazioni
Gli autori non hanno informazioni pertinenti.
Dichiarazione di consenso
Il paziente di cui al presente articolo video ha dato il proprio consenso informato per essere filmato ed è consapevole che informazioni e immagini saranno pubblicate online.
Citazioni
- Hollenbeck ST, Grobmyer SR, Kent KC, Brennan MF. Trattamento chirurgico ed esiti di pazienti con leiomiosarcoma primario della vena cava inferiore. J Am Coll Surg. 2003;197 (4): 575-579. doi:10.1016 / S1072-7515 (03)00433-2.
- Wachtel H, Gupta M, Bartlett EK, et al. Risultati dopo la resezione di leiomiosarcomi della vena cava inferiore: un’analisi dei dati aggregati di 377 casi. Chirurgo Oncol. 2015;24(1):21-27. doi: 10.1016 / j.suronc.2014.10.007.
- Kieffer E, Alaoui M, Piette JC, Cacoub P, Chiche L. Leiomiosarcoma della vena cava inferiore: esperienza in 22 casi. Ann Surg. 2006;244 (2): 289-295. doi:10.1097 / 01.SLA.0000229964.71743.DB.
- Cananzi FCM, Mussi C, Bordoni MG, et al. Ruolo della chirurgia nel trattamento multimodale del leiomiosarcoma primario e ricorrente della vena cava inferiore. J Surg Onkol. 2016;114(1):44-49. doi: 10.1002 / jso.24244.
- Ganeshalingam S, Rajeswaran G, Jones RL, Thway K, Moskovic E. Leiomiosarcomi della vena cava inferiore: caratteristiche diagnostiche sull’imaging trasversale. Clin Radiol. 2011;66(1):50-56. doi:10.1016 / j.crad.2010.08.004.
- Dull BZ, Smith B, Tefera G, Weber S. Gestione chirurgica del leiomiosarcoma retroperitoneale derivante dalla vena cava inferiore. J Chirurgia gastrointestinale 2013;17(12):2166-2171. doi:10.1007 / s11605-013-2385-0.
- Perl L, Virchow R. Un caso di sarcoma della vena cava inferiore. Archiv für pathologische Anatomie und Physiologie und für klinische Medicin. 1871;53(4):378-383. doi: 10.1007 / BF01957198.
- Melchior E. Sarcoma della vena cava inferiore. Rivista tedesca di Chirurgia. 1928;213(1-2):135-140. doi: 10.1007 / BF02796714.
- Mingoli A, Cavallaro A, Sapienza P, Di Marzo L, Feldhaus RJ, Cavallari N. Registro internazionale della vena cava inferiore leiomiosarcoma: analisi di una serie mondiale su 218 pazienti. Antitumorale Res. 1996;16(5B):3201-3205.
- Fiore M, Colombo C, Locati P, et al. Tecnica chirurgica, morbilità ed esito del sarcoma retroperitoneale primario che coinvolge la vena cava inferiore. Ann Chirurgo Oncol. 2012;19(2):511-518. doi:10.1245 / s10434-011-1954-2.